题目内容
【题目】含有锌粉 6.5g、铁粉 5.6g、铜粉 3.2g、铝粉 1.8g 的混合物与一定质量的稀硫酸充分反 应,反应停止后,有 8.8g 固体剩余。
(1)其中一个反应的化学方程式为_____。
(2)生成氢气的质量为_____g。
【答案】2Al+3H2SO4=Al2(SO4)3+3H2↑(或Zn+H2SO4=ZnSO4+H2↑) 0.4
【解析】
当 Al、Zn、Fe 同时遇到稀硫酸时,反应的先后顺序为 Al > Zn >Fe,根据题中信息可知, 有8.8g 固体剩余,则 8.8g 固体为 3.2g 铜和 5.6g 铁,所以参加反应的只有 6.5g 锌粉和1.8g 铝粉。设1.8g 铝粉完全反应生成氢气的质量为x,6.5g 锌粉完全反应生成氢气的质量为y。
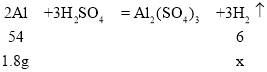
![]() ,解得x=0.2g
,解得x=0.2g
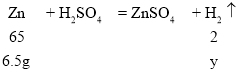
![]() ,解得y=0.2g
,解得y=0.2g
故生成氢气的质量为:0.2g+0.2g= 0.4g。

练习册系列答案
相关题目