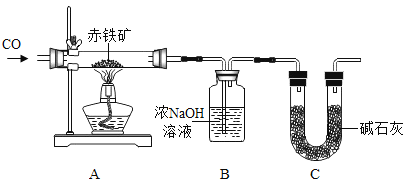
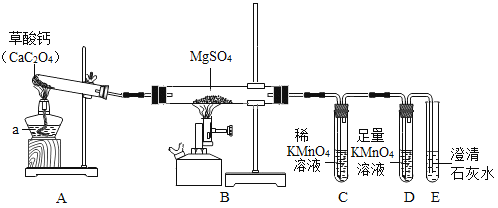
题目内容
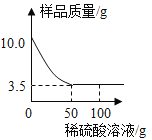
【题目】某黑色固体粉末可能是Fe 、FeO、CuO、C中的一种或几种。为了探究其成分,小明同学按照下图所示流程进行了实验。
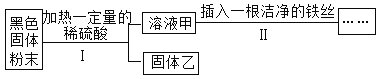
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有Fe;
②若步骤II中无明显现象,则固体乙中最多只能有四种物质;
③若步骤Ⅱ中有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无CuO;
⑤若固体乙呈红色.则原固体中一定含有Fe和CuO。
以上说法中正确的个数是( )
A.1个B.2个C.3个D.4个
【答案】A
【解析】
根据C不与稀硫酸反应;氧化铜可以与稀硫酸反应,生成的Cu2+在水溶液中显蓝色;Fe可以与稀硫酸反应生成气体;Fe、FeO与硫酸反应生成的Fe2+在水溶液中显浅绿色;铁的活动性大于铜,能将铜从其盐溶液中置换出来,据此分析判断有关的说法。
①若溶液甲呈浅绿色,则原黑色固体粉末中不一定含有Fe,FeO也可以与稀硫酸反应生成的Fe2+在水溶液中显浅绿色;故①错误;
②若步骤Ⅱ中无明显现象,说明了溶液中无硫酸铜,没有剩余的硫酸,如果硫酸的量不足,则固体乙中最多可以有Fe、FeO、CuO、C、Cu五种物质,故②错误;
③若步骤Ⅱ中有气泡产生,说明了硫酸是过量的,则固体乙可能含有铜,不一定是碳,则原固体一定是混合物,故③错误;
④若步骤Ⅱ中有红色固体析出,说明了溶液中含有硫酸铜,能判断黑色粉末中含有CuO,不能判断固体乙中是否有CuO,故④错误;
⑤固体乙呈红色,说明有铁置换出的铜,则原固体中一定含有Fe和CuO.故⑤正确。
故只有⑤是正确的,故选A。

 名校课堂系列答案
名校课堂系列答案【题目】为证明氧化铁也是过氧化氢分解的催化剂,小明设计以下实验方案
实验 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 取5mL蒸馏水于试管中,加入1g氧化铁,再伸入带火星木条 | 没有明显现象 | 氧化铁加入到水中不生产氧气 |
实验2 | 取5mL5%的过氧化氢溶液于试管中,加入1g氧化铁,再伸入带火星的木条 | 有大量气泡产生,带火星的木条复燃 |
请回答:(1)写出“实验2”中的实验结论_____。
(2)写出“实验2”中的文字表达式_____。
(3)小亮同学认为小明的实验方案中缺少一个对比实验(即下表中的“实验3”),请你帮小亮同学写出该对比实验中的实验操作。
实验操作 | 实验现象 | 实验结论 | |
实验3 | _____ | 有少量气泡产生,木条不复燃 | 过氧化氢溶液在常温下能缓慢分解;不足以使带火星的木条复燃 |
(4)小红同学认为以上三个实验都不足以证明氧化铁就是过氧化氢分解的催化剂,还需要完成另外两个实验,这两个实验的实验目的分别是:
①证明氧化铁的质量在化学反应前后没有改变
②_____。
(5)把实验2反应后的液体进行过滤,洗净,干燥,称量所得的固体,它的质量是_____g。