题目内容
【题目】某同学配制50g 6%氢氧化钠溶液,整个操作过程如图1所示,回答下列问题:
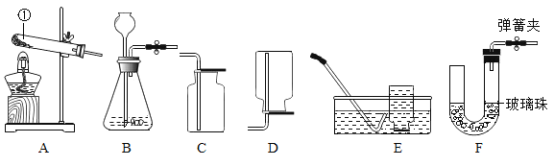
(1)图①中盛放氢氧化钠固体的仪器名称是_____,需称取氢氧化钠_____g,配制时应选用_____mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。
(2)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____(填序号)。
A 氢氧化钠固体不纯
B 用生锈砝码称量
C 装瓶时有少量溶液洒出
D 溶解时烧杯内壁有水珠
(3)欲测定此NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_____(填“偏大”、“偏小”或“不受影响”)。
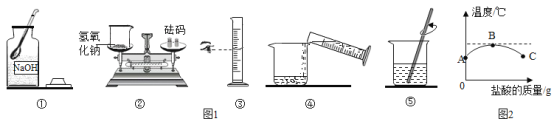
(4)室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度随加入盐酸质量而变化的曲线如图2所示。
①B处溶液的溶质是_____(填化学式)
②在C点溶液中加入碳酸钙,反应的化学方程式为_____。
【答案】广口瓶 3 50 AD 偏小 NaCl CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】
(1)氢氧化钠是固体,盛放在广口瓶中;配制50g 6%氢氧化钠溶液需要称取氢氧化钠的质量为50g×6%=3g,需量水的体积为47mL,应选用50mL的量筒量取蒸馏水;
(2)A 氢氧化钠固体不纯,使氢氧化钠质量偏小,配制的溶液溶质质量分数偏小,A正确;
B 用生锈砝码称量,会使称量的氢氧化钠质量偏大,配制的溶液溶质质量分数偏大,B错误;
C 装瓶时有少量溶液洒出,溶液具有均一性,对配制的溶液溶质质量分数没有影响,C错误;
D 溶解时烧杯内壁有水珠,会使配制溶液中水的质量偏大,配制的溶液溶质质量分数偏小,D正确。故选AD;
(3)氢氧化钠溶液呈碱性,测定NaOH溶液的pH,先将pH试纸用蒸馏水润湿,相当于将氢氧化钠溶液冲稀,会使所测溶液的pH偏小。
(4)①B处温度最高,说明盐酸与氢氧化钠恰好完全反应,此时溶液的溶质是NaCl;
②在C点盐酸过量,溶液中加入碳酸钙,盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑。

【题目】合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任一种组成金属的熔点。下表是一些金属的熔点数据:
金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
熔点/℃ | 1083 | 4194 | 231.9 | 327.5 | 271.3 | 320.9 |
(1)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_____(填物质名称)的质量分数;当合金熔点最低时,合金中铅与锡的质量比为:_____。
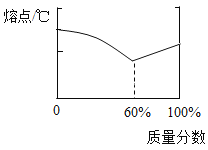
(2)保险丝由铋、铅、锡、镉组成,其熔点约为_____。
A 15~30℃
B 50~80℃
C 235~250℃
D 300~320℃