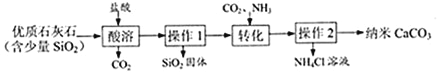
��Ŀ����
����Ŀ��Ϊ�˲ⶨ�����������ʵĸ�����ع�����Ʒ�и�����ص�����������ȡ20g��Ʒ����(���ʲ���Ӧ)��ʣ���������������ʱ��Ĺ�ϵ�����ʾ��
����ʱ��/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
ʣ���������/g | 20 | 20 | 19.6 | 18.8 | 18.6 | 18.4 | 18.4 |
(1)t0��t1ʱ��Σ��������������ԭ����____________________________��
(2)��Ӧ�в���������������_________��
(3)����Ʒ�и�����ص���������_________��
(4)�÷�Ӧ��ת��Ϊ��������Ԫ������ռ�����������Ԫ��������________%��
���𰸡� �ոտ�ʼ����δ�ﵽ������صķֽ��¶� 1.6g 79% 25%
��������������ع�����Ҫ���ȵ�һ�����¶Ȳ��ֽܷ⣬��һ��ʼû��������������������������
��2���ɱ���֪���¶ȼ��ȵ�t5ʱ��������������ټ��٣�˵�����������ȫ�ֽ⣬����������������Ϊ20g-18.4g=1.6g��
����Ʒ�и�����ص�����Ϊx
2KMnO4�� K2MnO4+MnO2+O2��
316 32
X 1.6g
![]() =
=![]() ��x=15.8g
��x=15.8g
��Ʒ�и�����ص���������Ϊ15.8![]() 100%=79%��
100%=79%��
15.8g�����������Ԫ�ص�����Ϊ15.8g![]() =6.4g������������Ϊ1.6g��1.6g
=6.4g������������Ϊ1.6g��1.6g![]() 100%=25%���ʷ�Ӧ��ת��Ϊ��������Ԫ������ռ�����������Ԫ������25%��
100%=25%���ʷ�Ӧ��ת��Ϊ��������Ԫ������ռ�����������Ԫ������25%��

����Ŀ����������ʦ����ѧ��̽���������غ㶨�����Ľ�ѧƬ�Σ��������̽������æ��д�ո�(�������еĿո�)��
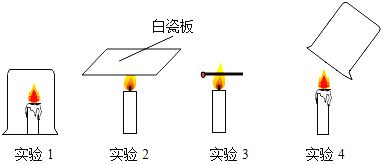
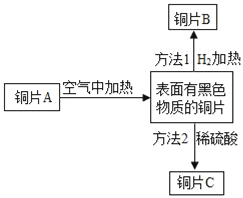
��������⡿��ѧ��Ӧǰ������ʵ������ܺ��Ƿ���ȣ�
����������衿����1������ȣ� ����2����ȡ�
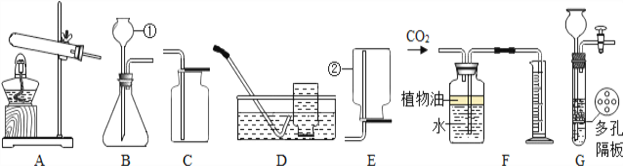
��ʵ��̽�����ס�������ͬѧ��������ƽ�ֱ������Ӧǰ�����ʵ�������
���� | ���� | |
ʵ�鷽��(��Ӧ����) |
|
|
ʵ������ | �����ݲ�������ƽָ������ƫת | �������� ______����Һ____����ƽָ��_________ƫת |
���� | ����1��ȷ���йط�Ӧ�ķ���ʽ�ǣ�Na2CO3+2HCl | ����2��ȷ����Ӧ�Ļ�ѧ����ʽ��___________________ |
����˼���ۡ��������ֲ�����ȷ��ͨ�����ۣ�ͬѧ�Ƿ��ּ��������������������ָ������ƫת���õ���ʾ����̽����ѧ��Ӧǰ������ʵ������ܺ��Ƿ����ʱ���������������ɻ�μӵķ�Ӧһ��Ҫ��____________�н��С�
���Ż�װ�á�ͬѧ�ǶԼ��������еķ�Ӧװ�ý������������ָĽ�������Ϊ���װ����___(�����)������������װ������ѡһ��ָ���䲻��______(��֪NaOH��Һ����ȫ����CO2����)
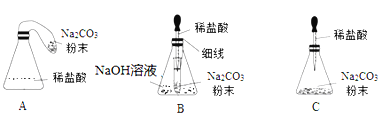
���ó����ۡ�ͬѧ�����øĽ�������װ�ý����ٴ�̽�������ó��������ȷ����һ���������֣���Ӧ��ϵ�����ĺ�δ�μӷ�Ӧ�����ʵ������ڷ�Ӧǰ�ֲ��䣬���յó������ǣ�____�ĸ����ʵ������ܺ͵��ڷ�Ӧ�����ɵĸ����ʵ������ܺ͡�
������Ӧ�á����ͣ���ѧ��Ӧǰ��ԭ�ӵ����ࡢ��Ŀ�����������䣬���������غ㡣
Ӧ�ã�ij�����������Ȼᷢ���ֽⷴӦ����������ͭ��ˮ�Ͷ�����̼�������ʣ���ù�������һ����_________��Ԫ����ɡ�