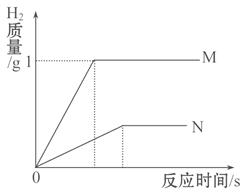
题目内容
(3分)取含Na2CO3和NaCl的样品34g放在烧杯中并加入稀盐酸146g,恰好完全反应,此时,烧杯内溶液的总质量为175.6g。
计算:反应后所得溶液的溶质质量分数。
20.0%
解析试题分析:根据题意可知:反应前物质的总质量为34g+146g=180g;反应后溶液的总质量为175.6g。所以可知反应生成的二氧化碳的质量为180g-175.6g="4.4g"
已知量:二氧化碳的质量; 未知量:所得溶液的溶质质量分数。
解题思路:可根据二氧化碳与碳酸钠、氯化钠(生成)在反应中的质量关系,求出碳酸钠和生成氯化钠的质量。进一步求出样品中的氯化钠的质量。即可计算出所得溶液中溶质氯化钠的总质量。最后再计算所得氯化钠溶液中的溶质质量分数。具体过程如下:
解:根据题意可知,生成二氧化碳的质量为:34g+146g-175.6g=4.4g
设样品中含有碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
106:44=x:4.4g x=10.6g
117:44=y:4.4g y=11.7g
则所得溶液中溶质的质量分数为: ×100%≈20.0%
×100%≈20.0%
答:所得溶液中的溶质质量分数为20.0%
考点:综合计算

 冲刺100分1号卷系列答案
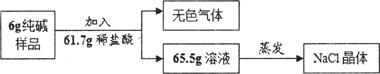
冲刺100分1号卷系列答案(7分))课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿
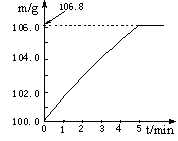
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。