题目内容
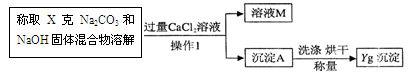
(5分)超市卖的纯碱产品中往往会含有少量的氯化钠,为了测定其组成,某校化学兴趣小组的同学对其进行了如下实验:
(1)用试管取适量样品,先向其中加入过量稀硝酸,再滴入适量硝酸银溶液,若观察到 ,则证明该样品中含有氯化钠。
(2)为测定该产品中碳酸钠的含量,进行如下定量实验: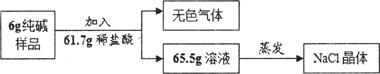
①根据质量守恒定律,该实验所得无色气体的质量是 。
②计算该6g纯碱样品中碳酸钠的质量,请写出计算过程。(计算结果精确至O.lg)
⑴ 出现白色沉淀(1分)
⑵① 2.2g ②5.3g
解析试题分析:用试管取适量样品,先向其中加入过量稀硝酸,再滴入适量硝酸银溶液,若观察到有白色沉淀产生,则说明其中存在氯离子,所以样品中有氯化钠,根据质量守恒定律,该实验所得无色气体的质量是6+61.7-65.5=2.2g,产生的气体为二氧化碳,可以根据二氧化碳质量计算碳酸钠的质量
解:设Na2CO3质量为x,则
Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2 ↑
∵ 106 44
x 2.2g
∴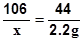 得 x = 5.3g
得 x = 5.3g
考点:根据化学方程式进行计算

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目