题目内容
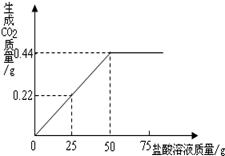
(3分)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。硅生产过程中的一个重要化学反应为SiO2 + 2C 高温 Si + 2CO↑。若生产5.6 g硅,理论上需要二氧化硅(SiO2)多少克?
12 g
解析试题分析:已知量:硅的质量5.6 g 未知量:需要的二氧化硅的质量。
解题思路:可通过化学方程式中二者的质量关系求解。具体过程如下:
解:设理论上需要二氧化硅的质量为x。
SiO2 + 2C高温Si + 2CO↑
60 28
X 5.6g ………………………… (1分)
60 :X = 28:5.6g ………………………… (1分)
x=12 g ………………………… (1分)
答:需要的二氧化硅的质量为12 g。
考点:根据化学方程式的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(9分)医用二水合氯化钙可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用二水合氯化钙的工艺流程为: (已知二水合氯化钙在温度超过160°C时分解为氯化钙和水)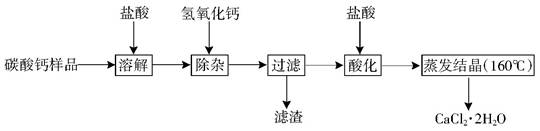
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的的pH(X)范围是 ;滤渣A的主要成分的化学式为 。
(3)酸化时加盐酸的主要目的为了 。
(4)蒸发结晶时,必须控制温度低于160℃的原因是 。
(5)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少 ?(写出计算过程,3分)