题目内容
【题目】某中学化学兴趣小组通过实验测定某大理石中碳酸钙的质量分数。将盛有一定量该样品的烧杯放在电子秤上,倒入100.0g稀盐酸(假设大理石样品中的杂质不与稀盐酸反应,也不溶于水),使该样品完全反应,已知烧杯的质量为60.0g,实验过程中的有关数据如下表:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
烧杯与所盛物质质量/g | 186.0 | 183.0 | 181.0 | 180.0 | 179.4 | 179.4 |
试计算:
(1)碳酸钙中碳元素与氧元素的质量比(最简比)为_________。
(2)生成二氧化碳的质量为_________g。
(3)求该大理石中碳酸钙的质量分数___________(精确到0.1%)。
【答案】1:4 6.6 57.7%
【解析】
(1)碳酸钙化学式为![]() ,其中碳元素与氧元素质量比为12:16×3=1:4;
,其中碳元素与氧元素质量比为12:16×3=1:4;
(2)根据反应未开始时烧杯中总质量186g,可知加入大理石样品质量为186g-100g-60g=26g;随着反应进行,跑掉二氧化碳,烧杯中总质量不断减少,最后保持在179.4g不再减少,说明反应停止,可知共生成二氧化碳质量为:186g-179.4g=6.6g。
(3)设大理石中碳酸钙的质量分数为x
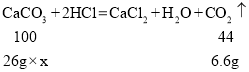
![]()
x≈57.7%。

练习册系列答案
相关题目
【题目】在一密闭容器中有CO2、H2O、O2和物质R,在一定条件下充分燃烧,测得反应前后各物质的质量如表。下列说法正确的是
物质 | R | O2 | CO2 | H2O |
反应前质量/g | 2.3 | 10.0 | 0.3 | 0.5 |
反应后质量/g | 0 | 5.2 | 4.7 | x |
A.x的值为3.7
B.R的化学式为C2H6
C.该反应属于分解反应
D.该反应中CO2与H2O的化学计量数之比为2∶3