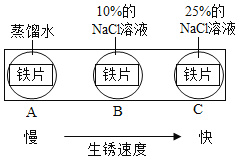
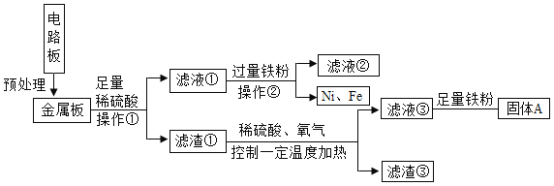
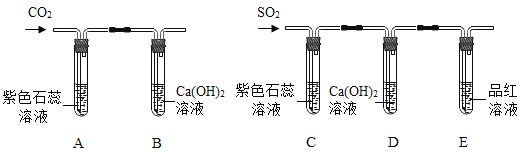
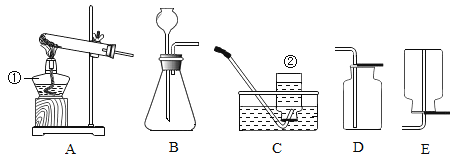
题目内容
【题目】某元素的原子结构示意图和该元素在元素周期表中的单元格如图所示,下列说法不正确的是()
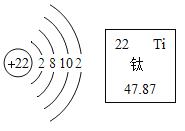
A.该原子的质量由构成其原子的质子和电子决定
B.该原子在化学变化中容易失去电子
C.该原子的核电荷数为22
D.该元素属于金属元素
【答案】A
【解析】
A、根据原子的质量主要集中在原子核上,原子核是由质子和中子构成的,则该原子的质量由构成其原子的质子和中子决定,电子质量很小,忽略不计,故选项说法错误。
B、由最外层电子数是2,该原子在化学变化中容易失去2个电子,故选项说法正确。
C、根据图中元素周期表中的一格可知:左上角的数字表示原子序数;原子序数=质子数=核电荷数=22,故选项说法正确。
D、由该元素在元素周期表中的单元格,该元素为钛元素,属于金属元素,故选项说法正确。
故选:A。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】某中学化学兴趣小组通过实验测定某大理石中碳酸钙的质量分数。将盛有一定量该样品的烧杯放在电子秤上,倒入100.0g稀盐酸(假设大理石样品中的杂质不与稀盐酸反应,也不溶于水),使该样品完全反应,已知烧杯的质量为60.0g,实验过程中的有关数据如下表:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
烧杯与所盛物质质量/g | 186.0 | 183.0 | 181.0 | 180.0 | 179.4 | 179.4 |
试计算:
(1)碳酸钙中碳元素与氧元素的质量比(最简比)为_________。
(2)生成二氧化碳的质量为_________g。
(3)求该大理石中碳酸钙的质量分数___________(精确到0.1%)。
【题目】铜元素广泛存在于各种物质中,如CuFeS2、Cu2(OH)2CO3、Cu-Zn合金等。
(1)金属Cu的用途________。(写一条)
(2)写出CuFeS2中Cu的质量分数计算式_________(无需化简)。
(3)现要测定某Cu-Zn合金中Cu的质量。称取l3g该合金粉末于烧杯中,将稀HCl分三次倒入,实验数据如下表所示。
实验编号 | 第一次 | 第二次 | 第三次 |
加入的稀HCl的质量/g | 100 | 100 | 100 |
生成氢气的质量/g | 0.08 | 0.16 | 0.16 |
①分析上表,恰好完全反应的是第__________次实验。
②计算:该l3g合金中Cu的质量______。(根据化学方程式写出完整的计算步骤)。
【题目】某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
第一站:初识金属镁。
(1)金属镁的物理性质:_____________(写一条)。
(2)金属镁的化学性质:镁能与氧气反应,反应的化学方程式为_______________。
第二站:再遇金属镁。
探究镁与盐酸反应过程中的能量变化以及反应速率的变化。
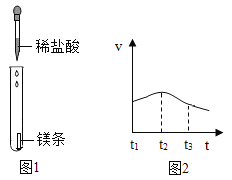
(1)实验时需将镁条进行打磨,其目的是_____________。
(2)如图1将稀盐酸逐滴滴入。放有镁条的试管中,反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),化学方程式为____________。
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是____________。
第三站:再探金属镁
(提出问题)金属镁能否与热水反应?如果反应,产物是什么?
(相关信息)①氢氧化镁在热水中能部分溶解,其溶液显碱性,在常温下不溶于水:
②无色酚酞遇碱性溶液变红。
(实验探究)填写下表:
实验操作 | 实验现象 | 实验结论 |
_______________ | 气体被点燃,发出淡蓝色火焰 | 镁能与热水反应生成氢气 |
______________ | ___________ | 镁能与热水反应生成氢化镁 |
根据以上实验,写出该反应的化学方程式___________。
第四站:实验总结应用。
总结上述寻镁之旅中你收获到镁的化学性质有____________(要写全)。金属镁有广泛用途,请举一例_________。