题目内容
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验![]() 图
图![]() 。
。
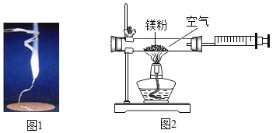
(1)请写出镁条与氧气反应的化学方程式_____其基本反应类型_____。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是_____。
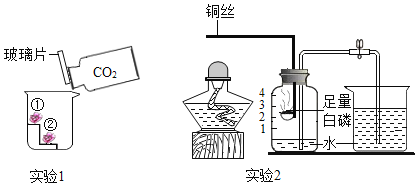
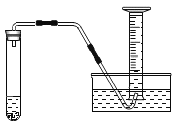
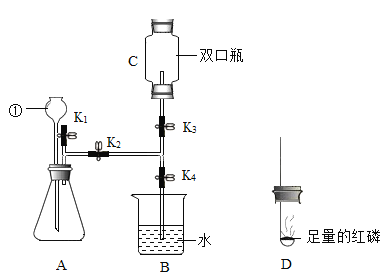
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁![]() 固体;
固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
(做出猜想)黄色固体为![]()
(实验探究)
实验操作 | 实验现象及结论 |
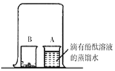
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:_____。 结论:燃烧产物中含 |
(反思与交流)
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。_____。
②空气中![]() 的含量远大于
的含量远大于![]() 的含量,而镁条在空气中燃烧生成的MgO却远多于
的含量,而镁条在空气中燃烧生成的MgO却远多于![]() ,为什么呢?请给出合理的解释_____。
,为什么呢?请给出合理的解释_____。
(拓展延伸)
①如果用图2装置![]() 气密性良好
气密性良好![]() 和药品
和药品![]() 足量
足量![]() 测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量取值范围_____。
【答案】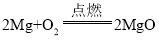 化合反应 部分生成的产物氧化镁散失到空气中 A中酚酞溶液变红色 化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变 氮气化学性质不如氧气活泼 大于 大于
化合反应 部分生成的产物氧化镁散失到空气中 A中酚酞溶液变红色 化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变 氮气化学性质不如氧气活泼 大于 大于![]() 小于4g
小于4g
【解析】
根据化学反应四大基本类型的概念,质量守恒验证实验中注意事项,氧气含量的测定中不可用镁替代红磷的原因,结合题目给定的查阅资料进行综合分析解答。
(1)镁和氧气在点燃的条件下生成氧化镁,配平即可得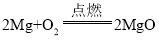 ,属于化合反应;
,属于化合反应;
(2)镁条完全燃烧时产生大量白烟,此白烟实际为生成的氧化镁,所称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,故其主要原因是:部分生成的产物氧化镁散失到空气中;
(3)如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B,由分子都在不停的运动及实验结论结论:燃烧产物中含![]() ,且查阅资料氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红;故实验现象为A中酚酞溶液变红色;
,且查阅资料氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红;故实验现象为A中酚酞溶液变红色;
反思与交流:①在发生化学反应前后各物质的质量总和相等的原因是:化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变;②空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于![]() ,因为氮气化学性质不如氧气活泼;
,因为氮气化学性质不如氧气活泼;
拓展延伸:①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,,因为氮气参加的反应,该实验所测得的氧气体积分数大于五分之一;②采用极限法,![]() 镁条在氧气中完全燃烧,生成氧化镁的质量是4g;
镁条在氧气中完全燃烧,生成氧化镁的质量是4g;![]() 镁条在氮气中完全燃烧,生成氮化镁的质量是
镁条在氮气中完全燃烧,生成氮化镁的质量是![]() 故所得固体质量取值范围大于3.33g小于4g;
故所得固体质量取值范围大于3.33g小于4g;

 优等生题库系列答案
优等生题库系列答案