题目内容
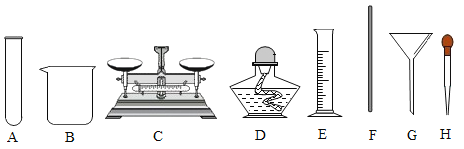
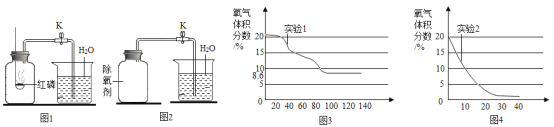
【题目】实验室利用下图装置制取氧气,并检验氧气的性质。
(1)如果用氯酸钾制取较纯净的氧气时,制取装置应该选择的仪器是_________(填序号),反应的化学方程式为______________________。
(2)利用上述装置制取氧气时,判断是否收集满的方法是______________。
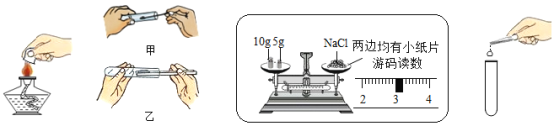
(3)某研究性学习小组利用所学知识进行了下列实验研究。利用某氯酸钾样品(杂质不参与反应)分解制取氧气,并测定氯酸钾的质量分数,实验结束时如图所示(导管出口高于液面)。
①测量收集到气体体积必须包括的几个步骤:
a调整量筒内外液面高度使之相同;
b使试管和量筒的气体都冷却到室温;
c读取量筒内气体的体积。
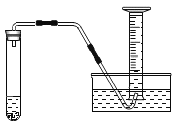
这三步操作的正确顺序是__________________(填写步骤代号)。
②测量收集到的气体体积时,应使量筒内外液面相平,如果所示液面位置,使量筒内外液面高度相同的方法是___________________。
③本实验过程中,将导管放入装满水的量筒的时机为_______________。
a加热前,还没有气泡产生时
b加热一会儿,气泡连续均匀产生时
c加热后,移开酒精灯时
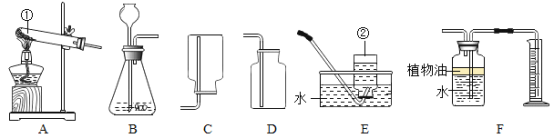
(4)如果用过氧化氢分解制取氧气,反应的化学方程式为________________。B瓶中锥形瓶放入的固体的作用是__________________,B装置中使用分液漏斗不使用长颈漏斗的原因是____________。C的收集方法称为___________法,适合于收集___________________的气体。
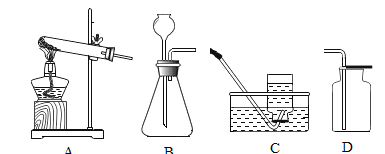
(5)如图装置,连接好仪器,用于制取氧气以及验证氧气的性质(双口瓶上下部开口):
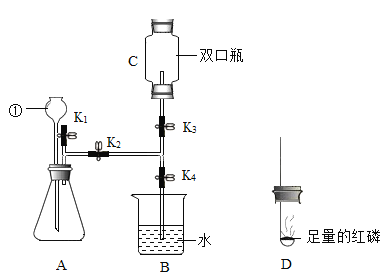
①检查好装置气密性良好后,打开弹簧夹![]() 、
、![]() ,关闭
,关闭![]() 、
、![]() ,用C装置收集的气体的方法是____________(填选项字母)。
,用C装置收集的气体的方法是____________(填选项字母)。
a排水法 b向下排空气法 c向上排空气法
②检验C中收集满气体的方法是_______________。
③C中收集满氧气后,打开弹簧夹![]() 、
、![]() ,关闭
,关闭![]() 、
、![]() ,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是___________,待红磷媳灭,C装置冷却后,打开
,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是___________,待红磷媳灭,C装置冷却后,打开![]() 观察到的现象是_______________。
观察到的现象是_______________。
④写出燃烧匙中的反应方程式________________,其中打开![]() 的目的是____________________。
的目的是____________________。
【答案】AC  集气瓶口有大量气泡逸出 bac 慢慢将量筒下移 b
集气瓶口有大量气泡逸出 bac 慢慢将量筒下移 b 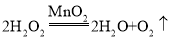 催化作用 分液漏斗可以控制液体滴加速度,获得平稳的气流 排水法 难溶于水 c 用带火星的木条置于双口瓶上端,若复燃,则集满 剧烈燃烧,发出白光,放热,产生大量白烟 烧杯B中的水进入C中
催化作用 分液漏斗可以控制液体滴加速度,获得平稳的气流 排水法 难溶于水 c 用带火星的木条置于双口瓶上端,若复燃,则集满 剧烈燃烧,发出白光,放热,产生大量白烟 烧杯B中的水进入C中  排出A装置中继续产生的气体,防止瓶内压强过大
排出A装置中继续产生的气体,防止瓶内压强过大
【解析】
1)如果用氯酸钾制取较纯净的氧气时,选择固体加热装置A,排水法收集氧气更更纯净,选择装置C。故制取装置应该选择的仪器是AC,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)利用上述装置制取氧气时,判断是否收集满的方法是:集气瓶口有大量气泡逸出;
(3)某研究性学习小组利用所学知识进行了下列实验研究。利用某氯酸钾样品(杂质不参与反应)分解制取氧气,并测定氯酸钾的质量分数,①测量收集到气体体积正确顺序是:
b使试管和量筒的气体都冷却到室温;a调整量筒内外液面高度使之相同;c读取量筒内气体的体积。
故选bac;
②测量收集到的气体体积时,应使量筒内外液面相平,如果所示液面位置,使量筒内外液面高度相同的方法是:慢慢将量筒下移
③本实验过程中,将导管放入装满水的量筒的时机为:b气泡连续均匀时;
(4)如果用过氧化氢分解制取氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
B瓶中锥形瓶放入的二氧化锰固体的作用是:催化作用,加速过氧化氢溶液分解;B装置中使用分液漏斗不使用长颈漏斗的原因是:分液漏斗可以控制液体滴加速度,获得平稳的气流。C的收集方法称为排水法,适合于收集难溶于水的气体。
(5)①检查好装置气密性良好后,打开弹簧夹![]() 、
、![]() ,关闭
,关闭![]() 、
、![]() ,用C装置收集的气体的方法是: c向上排空气法;
,用C装置收集的气体的方法是: c向上排空气法;
②检验C中收集满气体的方法是:用带火星的木条置于双口瓶上端,若复燃,则集满;
③C中收集满氧气后,打开弹簧夹![]() 、
、![]() ,关闭
,关闭![]() 、
、![]() ,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是:剧烈燃烧,发出白光,放热,产生大量白烟,待红磷媳灭,C装置冷却后,打开
,点燃D中燃烧匙内的过量的红磷后,立即伸入C装置中并把塞子塞紧,观察到红磷燃烧的现象是:剧烈燃烧,发出白光,放热,产生大量白烟,待红磷媳灭,C装置冷却后,打开![]() 观察到的现象是:烧杯B中的水进入C中;
观察到的现象是:烧杯B中的水进入C中;
④写出红磷在氧气中燃烧的反应方程式:4P+5O2![]() 2P2O5,其中打开
2P2O5,其中打开![]() 的目的是:排出A装置中继续产生的气体,防止瓶内压强过大;
的目的是:排出A装置中继续产生的气体,防止瓶内压强过大;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验![]() 图
图![]() 。
。
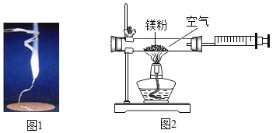
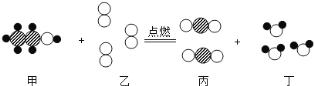
(1)请写出镁条与氧气反应的化学方程式_____其基本反应类型_____。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是_____。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁![]() 固体;
固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
(做出猜想)黄色固体为![]()
(实验探究)
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:_____。 结论:燃烧产物中含 |
(反思与交流)
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。_____。
②空气中![]() 的含量远大于
的含量远大于![]() 的含量,而镁条在空气中燃烧生成的MgO却远多于
的含量,而镁条在空气中燃烧生成的MgO却远多于![]() ,为什么呢?请给出合理的解释_____。
,为什么呢?请给出合理的解释_____。
(拓展延伸)
①如果用图2装置![]() 气密性良好
气密性良好![]() 和药品
和药品![]() 足量
足量![]() 测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量取值范围_____。