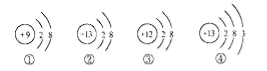
题目内容
【题目】根据下列实验回答问题。
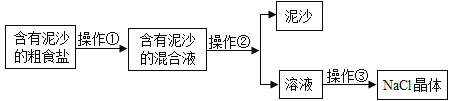
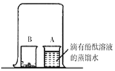
(1)实验1中,①②为用紫色石蕊溶液润湿的小花。能说明 CO2密度大于空气的现象是_____。欲证明CO2能与水反应,还需补充的实验是_____。
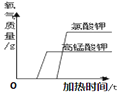
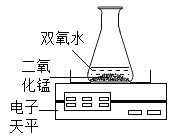
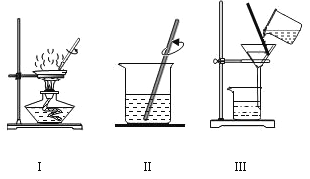
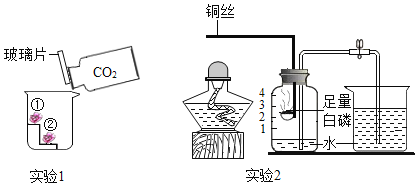
(2)实验2证明了氧气约占空气体积的![]() .点燃酒精灯加热铜丝一端,一段时间后,除观察到白磷燃烧、产生大量白烟外,还观察到现象是_____。该实验过程中,利用了铜的_____性,白磷燃烧的化学方程式为_____.
.点燃酒精灯加热铜丝一端,一段时间后,除观察到白磷燃烧、产生大量白烟外,还观察到现象是_____。该实验过程中,利用了铜的_____性,白磷燃烧的化学方程式为_____.
【答案】②比①先变红 将干燥的紫色石蕊小花放入二氧化碳气体中,作为参照 集气瓶中的水面先下降后上升最终停在1处 导热 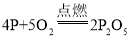
【解析】
(1)由于二氧化碳能与水化合生成了碳酸,所以实验1中,①②为用紫色石蕊溶液润湿的小花,能说明二氧化碳密度大于空气的现象是②比①先变红,欲证明二氧化碳能与水反应,还需补充的实验是将干燥的紫色石蕊小花放入二氧化碳气体中,作为参照。
(2)实验2证明了氧气约占空气体积的1/5,点燃酒精灯加热铜丝一端,一段时间后,除观察到白磷燃烧、产生大量白烟外,由于白磷燃烧消耗了氧气生成了五氧化二磷,还观察到现象是集气瓶中的水面先下降后上升最终停在1处,该实验过程中,利用了铜的导热性,白磷燃烧生成五氧化二磷,反应的化学方程式为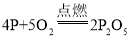 。
。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验![]() 图
图![]() 。
。
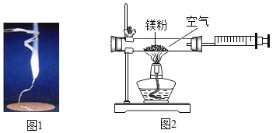
(1)请写出镁条与氧气反应的化学方程式_____其基本反应类型_____。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是_____。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁![]() 固体;
固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
(做出猜想)黄色固体为![]()
(实验探究)
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:_____。 结论:燃烧产物中含 |
(反思与交流)
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。_____。
②空气中![]() 的含量远大于
的含量远大于![]() 的含量,而镁条在空气中燃烧生成的MgO却远多于
的含量,而镁条在空气中燃烧生成的MgO却远多于![]() ,为什么呢?请给出合理的解释_____。
,为什么呢?请给出合理的解释_____。
(拓展延伸)
①如果用图2装置![]() 气密性良好
气密性良好![]() 和药品
和药品![]() 足量
足量![]() 测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量取值范围_____。