题目内容
【题目】市场上的加碘食盐通常加入的是碘酸钾(KI03),替代了 原来的碘化钾(KI),因为碘化钾容易被氧气氧化为探究不同条件下KI与02的反应,进行如下系列实验。
(查阅资料)
①碘单质(I2)遇淀粉液变蓝。
②部分酸、碱、盐通常在水溶液中以离子形式存在。如:盐酸中存在H+和Cl-。
(进行实验)
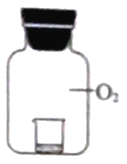
实验1将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ① 2mL0.15% KI 溶液 +5滴淀粉液 | 无明显变化 |
②2mL 1.5% KI 溶液 +5滴淀粉液 | 溶液变蓝 | |
③2mL 15% KI溶液+5 滴淀粉液 | 溶液变蓝,颜色较② 深 |
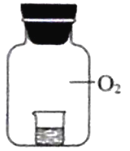
实验2将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
烧杯中的液体 | 现象 | |
| ④ 2mL 15% KI溶液+5 滴淀粉液+2mL蒸 馏水 | 无明显变化 |
⑤2mL 15% KI溶液+5 滴淀粉液+2mL1%盐 酸 | 溶液变蓝 | |
⑥2mL15% KI溶液+5 滴淀粉液+2 mL 10% 盐酸 | 溶液变蓝,颜色较⑤ 深 |
(解释与结论)
(1)实验1的目的是______________。
(2)实验2中通过对比⑤和⑥,得出的结论是______________。
(3)实验2中,KI在盐酸的作用下与02反应的化学方程式如下,补全该反应的化学方程式:4KI+02+4HCI=4KCI+2_______+_______。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是______________。
(5)某同学将实验⑤中2mL10%盐酸替换成2mL10%NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_____________________。
【答案】探究不同浓度的KI溶液与O2反应现象 向相同浓度的KI溶液中加入不同浓度的稀盐酸后置于纯氧中,盐酸浓度越大,KI越容易被氧化 I2 2H2O 作对比,排除水分子对实验的干扰 加速KI氧化的是H+
【解析】
(1)通过对比3组实验可知,向2ml浓度不同的KI溶液加入相同的淀粉溶液罝于纯氧中,现象不同,说明实验目的是探究不同浓度的KI溶液与O2反应的现象,故填探究不同浓度的KI溶液与O2反应现象;
(2)将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,⑥比⑤盐酸浓度大,5分钟后观察,溶液变蓝,颜色⑥比⑤深,说明其他条件相同时盐酸浓度越大,KI越容易被氧化,故填向相同浓度的KI溶液中加入不同浓度的稀盐酸后置于纯氧中,盐酸浓度越大,KI越容易被氧化;
(3)碘能使淀粉液变蓝,说明反应生成了碘单质,根据元素守恒可知另一种生成物为水,再质量守恒定律,反应前后原子的种类和数目都不变,可知化学方程式为4KI+O2+4HCl=4KCl+2I2+2H2O,两种物质的顺序没有要求,但是要注意化学计量数要对应,第一空故填I2;第二空故填2H2O;
(4)实验⑤⑥中分別加入了2ml稀盐酸,稀盐酸中有水,实验④中加入2ml蒸馏水的作用作对比,排除水分子对实验的干扰,故填作对比,排除水分子对实验的干扰;
(5)由查阅资料②可知,2mll0%稀盐酸和2mfl0%NaCl溶液中都存在相同浓度的Cl-,5分钟后溶液颜色无变化,说明加速KI被氧化的不是Cl-而是稀盐酸中的H+,故填加速KI氧化的是H+。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案