题目内容
【题目】某实验小组同学探究氢氧化钠溶液与稀盐酸的反应。向一种溶液中逐滴滴加另一种溶液,用传感器实时获得溶液的pH、温度变化曲线如下图所示。下列说法不正确的是
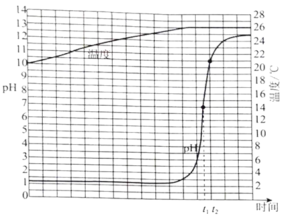
A. t1时,溶液呈中性
B. 该反应过程中有热量放出
C. 该实验是将稀盐酸滴入氢氧化钠溶液中
D. t2时,溶液中溶质为NaOH和NaCl
【答案】C
【解析】
A、由题目知,氢氧化钠与稀盐酸反应,发生中和反应,反应原理为NaOH+HCl=NaCl+H2O,在t1℃时,pH=7,呈中性,故不符合题意;
B、故由图像曲线变化可以得到,温度升高,反应为放热反应,不符合题意;
C、图像曲线变化pH从小到大变化,应为将氢氧化钠溶液滴入稀盐酸中,故符合题意;
D、在t2℃时,pH=ll,呈碱性,说明此时氢氧化钠溶液过量,溶液中溶质有NaCl和NaOH 两种溶质,故不符合题意。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
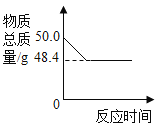
(1)以上两种物质的溶解度受温度影响较大的是_____。
(2)40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为_____g。
(3)20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)_____。
【题目】市场上的加碘食盐通常加入的是碘酸钾(KI03),替代了 原来的碘化钾(KI),因为碘化钾容易被氧气氧化为探究不同条件下KI与02的反应,进行如下系列实验。
(查阅资料)
①碘单质(I2)遇淀粉液变蓝。
②部分酸、碱、盐通常在水溶液中以离子形式存在。如:盐酸中存在H+和Cl-。
(进行实验)
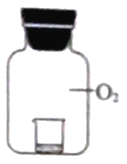
实验1将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ① 2mL0.15% KI 溶液 +5滴淀粉液 | 无明显变化 |
②2mL 1.5% KI 溶液 +5滴淀粉液 | 溶液变蓝 | |
③2mL 15% KI溶液+5 滴淀粉液 | 溶液变蓝,颜色较② 深 |
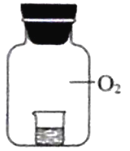
实验2将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
烧杯中的液体 | 现象 | |
| ④ 2mL 15% KI溶液+5 滴淀粉液+2mL蒸 馏水 | 无明显变化 |
⑤2mL 15% KI溶液+5 滴淀粉液+2mL1%盐 酸 | 溶液变蓝 | |
⑥2mL15% KI溶液+5 滴淀粉液+2 mL 10% 盐酸 | 溶液变蓝,颜色较⑤ 深 |
(解释与结论)
(1)实验1的目的是______________。
(2)实验2中通过对比⑤和⑥,得出的结论是______________。
(3)实验2中,KI在盐酸的作用下与02反应的化学方程式如下,补全该反应的化学方程式:4KI+02+4HCI=4KCI+2_______+_______。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是______________。
(5)某同学将实验⑤中2mL10%盐酸替换成2mL10%NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_____________________。