题目内容
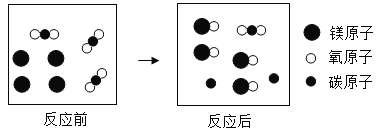
【题目】某化学兴趣小组在一次实验活动中发现镁、钠都能在纯净的二氧化碳气体中燃烧,反应后冷却,瓶底除了有黑色颗粒,瓶壁上还都附着白色物质。经检验,黑色颗粒是碳。他们对镁、钠在二氧化碳气体中燃烧后生成的白色物质分别进行了如下探究:
(探究问题一)镁在纯净的二氧化碳中燃烧生成的白色物质是什么?
同学们首先排除了是Mg(OH)2的可能性,理由是_____。
(做出猜想)白色固体可能是①MgO、②MgCO3、③_____。
(进行实验)取少量白色固体,加入足量的稀盐酸,观察到_____现象,猜想①正确。
(实验结论)镁在二氧化碳中燃烧的化学方程式是_____。
(探究问题二)钠在纯净的二氧化碳中燃烧生成的白色物质是什么?
(查阅资料)信息1:钠能与冷水发生剧烈反应。
信息2:Na2O+H2O=2NaOH
(实验设计)甲组方案:
实验步骤 | 实验现象 | 结论 |
取少量白色物质于试管中,加水溶解,加入足量Ba(OH)2溶液 | _____ | 白色物质中有Na2CO3 |
静置后,向上层清液滴加酚酞试液 | 溶液变红 | 白色物质中有Na2O |
甲组结论:白色固体为Na2O和Na2CO3的混合物
乙组方案:
取5.3克白色固体样品进行下列操作:
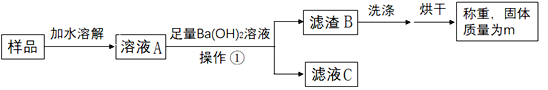
(1)操作①是_____。
(2)Ba(OH)2溶液必须足量的目的是_____。
该组同学测得m=9.85克,结合样品质量进行分析,最终得出结论:白色固体为Na2CO3。
(实验反思)
(1)为何甲、乙两组所得结论不相符,某同学分析后指出甲组方案不科学,应该将甲组方案中的Ba(OH)2溶液改为_____溶液才合理。
(2)钠在二氧化碳中燃烧的化学方程式为_____。
(拓展应用)
实验室里钠等金属因燃烧引发火灾时,可以选择的灭火方式有_____。
A 用水浇灭 B 用液态二氧化碳灭火器 C 撒沙土盖灭
【答案】反应物中无氢元素;反应前后元素种类相同;不遵循质量守恒定律(合理即可) MgO和MgCO3的混合物 无气泡产生 2Mg+CO2![]() 2MgO+C 产生白色沉淀 过滤 将Na2CO3完全反应或消耗(或将Na2CO3完全沉淀) BaCl2、Ba(NO3)2、CaCl2、Ca(NO3)2(任写一个) 4Na+3CO2
2MgO+C 产生白色沉淀 过滤 将Na2CO3完全反应或消耗(或将Na2CO3完全沉淀) BaCl2、Ba(NO3)2、CaCl2、Ca(NO3)2(任写一个) 4Na+3CO2![]() 2Na2CO3+C C
2Na2CO3+C C
【解析】
[探究问题一] 反应前后元素种类不变,反应物中无氢元素,不可能生成氢氧化镁。
[做出猜想]反应物中含有镁、碳、氧三种元素,所以白色固体可能是MgO、MgCO3,也可能是MgO、MgCO3的混合物。
[进行实验]氧化镁与稀盐酸反应生成氯化镁和水,碳酸镁与稀盐酸反应生成氯化镁、水、二氧化碳,所以取少量白色固体,加入足量的稀盐酸,观察到无气泡产生,则猜想①正确。
[实验结论]由实验探究可知,镁在二氧化碳中燃烧生成氧化镁,根据质量守恒定,反应的化学方程式为:2Mg+CO2![]() 2MgO+C
2MgO+C
[实验设计]
Ba(OH)2溶液能与碳酸盐反应生成白色沉淀。(1)通过过滤可将难溶于水的固体物质与液体分离,所以操作①是过滤。(2)Ba(OH)2溶液必须足量的目的是将Na2CO3完全反应或消耗掉。根据题给信息可知,m=9.85克是碳酸钡的质量,设白色固体样品中碳酸钠的质量是x。
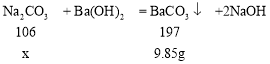
![]() ,解得x=5.3g,所以白色固体为Na2CO3。
,解得x=5.3g,所以白色固体为Na2CO3。
[实验反思]
(1)Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,加入氢氧化钡溶液,引入了碱性溶液,无论固体中是否含有氧化钠,静置后,向上层清液滴加酚酞试液,都会出现酚酞试液变红的现象,无法确定氧化钠是否存在。应该将甲组方案中的Ba(OH)2溶液改为BaCl2溶液[或Ba(NO3)2或CaCl2或Ca(NO3) 2)]溶液才合理,排除对氧化钠检验的干扰。
(2)根据实验探究可知,钠在二氧化碳中燃烧的化学方程式为:4Na+3CO2![]() 2Na2CO3+C
2Na2CO3+C
[拓展应用]
钠等活泼金属能与水、二氧化碳发生化学反应,故钠等活泼金属燃烧引发火灾时,可以选择的灭火方式有撒沙土盖灭,以隔绝氧气,故选C。

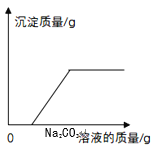
【题目】海水中含有大量的氯化钠,工业上常用精制的氯化钠为原料制备纯碱,请你回答下列问题:
(1)从物质的元素组成上分析,需要加入含______元素的物质,但实际生产过程中,通常是先向饱和食盐水中通入氨气,制成饱和氨盐水,原因是______________________________________。
(2)工业上制得的纯碱中常含有少量的氯化钠(不考虑其它杂质),某化学兴趣小组的同学要测定某工厂生产的纯碱样品中碳酸钠的质量分数,设计如下方案:方案一:甲、乙、丙三位同学分別称取一定质量的样品放入烧杯中,溶入足量水后向滤液中加入一定质量的氯化钙溶液,充分反应后过滤,将沉淀洗涤、干燥并称量。相关实验数据记录如下表所示。
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 12 | 12 | 15 |
加入氯化钙溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 10 | 10 | 10 |
①请你分析上述数据,计算该样品中碳酸钠的质量分数。(写出计算步骤,计算结果保留到0.1%)______。
②方案二:丁同学用电子天平分别称取12g相同的碳酸钠样品和100g稀盐酸,充分反应后,测得烧杯内剩余物质的质量为108.6g,则该同学测得的碳酸钠的质量分数_________(填“大于”“小于”“等于”)方案一中测得的碳酸钠的质量分数。原因可能是_________________。(假设装置气密性良好)
【题目】分析处理图表中的信息是学习化学的一种重要方法。
(1)如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是_____g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为_____(只列计算式,不需要计算结果)。
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是_____。
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是_____。
(2)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
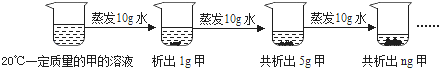
Ⅰ.蒸发前原溶液是_____(填“饱和”或“不饱和”)溶液。n的数值是_____。
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是_____(填字母)。
A 随温度升高而增大 B 随温度升高而减小 C 无法判断