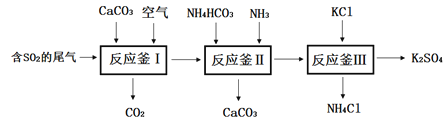
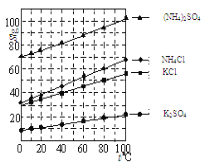
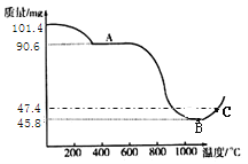
题目内容
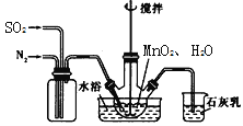
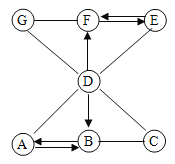
【题目】只含Fe、O两种元素的黑色固体14.4g进行如下图所示的实验,实验结束后,称得装置C质量增加了8.8g。根据实验数据分析,下列说法正确的是(假设各个反应均完全。已知FeO为黑色;CO中混有杂质CO2和H2O;碱石灰可吸收CO2和H2O)
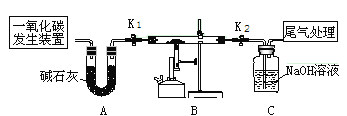
A. 实验开始前应先点燃酒精喷灯
B. 若无A装置,黑色固体中Fe元素质量分数将偏大
C. 根据实验数据进行计算,可确定玻璃管中的黑色固体一定是FeO
D. 实验结束时关闭K1、K2,可防止B中固体被氧化
【答案】D
【解析】
A、实验开始前应先通入一氧化碳气体排净玻璃管中的空气,防止加热一氧化碳与空气的混合气体遇热发生爆炸,选项错误;
B、若无A装置,则C装置会吸收一氧化碳中的二氧化碳和水,C装置的增重将会偏大,计算出的黑色固体中氧元素的质量偏大,则计算出的黑色固体中Fe元素质量分数将偏小,选项错误;
C、C装置的增重为生成的二氧化碳的质量,根据一氧化碳与金属氧化物反应可知,生成的二氧化碳中的氧元素有一半来自黑色固体,黑色固体中的氧元素的质量为8.8g×![]() ×100%×
×100%×![]() =3.2g,所以黑色固体中铁原子与氧原子的个数比为
=3.2g,所以黑色固体中铁原子与氧原子的个数比为![]() :
:![]() =1:1,黑色固体除为FeO,还可能是铁粉和四氧化三铁的混合物,选项错误;
=1:1,黑色固体除为FeO,还可能是铁粉和四氧化三铁的混合物,选项错误;
D、实验结束时关闭K1、K2,可防止空气进入装置B中使生成的金属被重新氧化,选项正确,故选D。

 小学教材完全解读系列答案
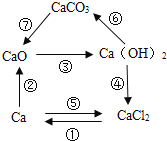
小学教材完全解读系列答案【题目】某化学兴趣小组在一次实验活动中发现镁、钠都能在纯净的二氧化碳气体中燃烧,反应后冷却,瓶底除了有黑色颗粒,瓶壁上还都附着白色物质。经检验,黑色颗粒是碳。他们对镁、钠在二氧化碳气体中燃烧后生成的白色物质分别进行了如下探究:
(探究问题一)镁在纯净的二氧化碳中燃烧生成的白色物质是什么?
同学们首先排除了是Mg(OH)2的可能性,理由是_____。
(做出猜想)白色固体可能是①MgO、②MgCO3、③_____。
(进行实验)取少量白色固体,加入足量的稀盐酸,观察到_____现象,猜想①正确。
(实验结论)镁在二氧化碳中燃烧的化学方程式是_____。
(探究问题二)钠在纯净的二氧化碳中燃烧生成的白色物质是什么?
(查阅资料)信息1:钠能与冷水发生剧烈反应。
信息2:Na2O+H2O=2NaOH
(实验设计)甲组方案:
实验步骤 | 实验现象 | 结论 |
取少量白色物质于试管中,加水溶解,加入足量Ba(OH)2溶液 | _____ | 白色物质中有Na2CO3 |
静置后,向上层清液滴加酚酞试液 | 溶液变红 | 白色物质中有Na2O |
甲组结论:白色固体为Na2O和Na2CO3的混合物
乙组方案:
取5.3克白色固体样品进行下列操作:
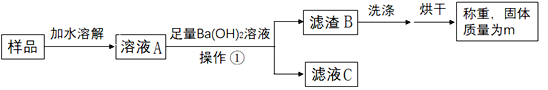
(1)操作①是_____。
(2)Ba(OH)2溶液必须足量的目的是_____。
该组同学测得m=9.85克,结合样品质量进行分析,最终得出结论:白色固体为Na2CO3。
(实验反思)
(1)为何甲、乙两组所得结论不相符,某同学分析后指出甲组方案不科学,应该将甲组方案中的Ba(OH)2溶液改为_____溶液才合理。
(2)钠在二氧化碳中燃烧的化学方程式为_____。
(拓展应用)
实验室里钠等金属因燃烧引发火灾时,可以选择的灭火方式有_____。
A 用水浇灭 B 用液态二氧化碳灭火器 C 撒沙土盖灭
【题目】某校兴趣小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品10g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 6 | m | 1.2 | 1.2 |
分析表中数据,完成下列问题:
(1)表中m的数值为___;
(2)计算稀盐酸的溶质质量分数____。
【题目】学完酸碱盐之后,小明头脑里一直有疑惑,为什么老师说金属活动顺序表中钾、钙、钠很活泼,却又不能把它后面金属从盐溶液中置换出来呢?带着疑问小明走进了实验室。
(查阅资料)钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
(实验探究)小明先取一定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,反应剧热,充分反应后过滤,得到滤液和蓝色滤渣,根据已学知识可推断蓝色滤渣为并对滤液的成分进行探究。
(猜想与假设)猜想一:Na2SO4;猜想二:Na2SO4和NaOH;猜想三_____。猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想_____不合理,理由是_____(用化学方程式表示)。
(查阅资料)Na2SO4溶液呈中性
(实验与验证)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | _____ | 猜想一不成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属确实_____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
(继续探究)小明将4.6g钠投入到含HCl 3.65g的稀盐酸中,反应更加剧热,这是因为钠的性质很活泼,很容易失去最外层的一个电子而形成_____。请计算该过程中产生H2的质量_____。