题目内容
【题目】下列图像能正确反映变化关系的是
A. 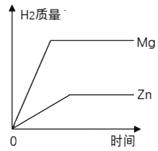 向等质量相同形状的镁片和锌片中分别加入相同浓度的稀硫酸至过量
向等质量相同形状的镁片和锌片中分别加入相同浓度的稀硫酸至过量
B. 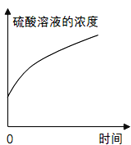 盛有浓硫酸的试剂瓶敞口露置于空气中
盛有浓硫酸的试剂瓶敞口露置于空气中
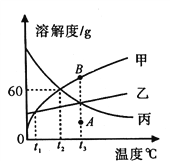
C. 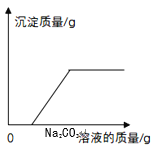 CaCl2和HCl的混合溶液中加入Na2CO3溶液至过量
CaCl2和HCl的混合溶液中加入Na2CO3溶液至过量
D.  Cu(NO3)2溶液中加入锌粉至过量
Cu(NO3)2溶液中加入锌粉至过量
【答案】AC
【解析】
A.镁的金属活动性比锌强,相等时间内镁产生的氢气多;与过量的稀硫酸反应,镁产生的氢气多,此选项正确;
B.浓硫酸具有吸水性,盛有浓硫酸的试剂瓶敞口露置于空气中,硫酸溶液的浓度变小,此选项错误;
C. CaCl2和HCl的混合溶液中加入Na2CO3溶液至过量,Na2CO3溶液先与HCl反应,Na2CO3+2HCl =2NaCl+H2O+CO2↑,当HCl完全反应以后,Na2CO3溶液才与CaCl2反应产生沉淀,Na2CO3+CaCl2 =CaCO3↓+2NaCl,故开始加入碳酸钠溶液无沉淀产生,此选项正确;
D. Cu(NO3)2溶液中加入锌粉至过量,由于锌比铜金属活动性强,发生反应:Zn+Cu(NO3)2=Zn(NO3)2 +Cu,由化学方程式可知,每65份质量的锌与足量硝酸铜反应生成64份质量的铜,反应后固体质量减少,则溶液质量增多至硝酸铜完全反应为止,此选项错误。故选AC。

【题目】某化学兴趣小组在一次实验活动中发现镁、钠都能在纯净的二氧化碳气体中燃烧,反应后冷却,瓶底除了有黑色颗粒,瓶壁上还都附着白色物质。经检验,黑色颗粒是碳。他们对镁、钠在二氧化碳气体中燃烧后生成的白色物质分别进行了如下探究:
(探究问题一)镁在纯净的二氧化碳中燃烧生成的白色物质是什么?
同学们首先排除了是Mg(OH)2的可能性,理由是_____。
(做出猜想)白色固体可能是①MgO、②MgCO3、③_____。
(进行实验)取少量白色固体,加入足量的稀盐酸,观察到_____现象,猜想①正确。
(实验结论)镁在二氧化碳中燃烧的化学方程式是_____。
(探究问题二)钠在纯净的二氧化碳中燃烧生成的白色物质是什么?
(查阅资料)信息1:钠能与冷水发生剧烈反应。
信息2:Na2O+H2O=2NaOH
(实验设计)甲组方案:
实验步骤 | 实验现象 | 结论 |
取少量白色物质于试管中,加水溶解,加入足量Ba(OH)2溶液 | _____ | 白色物质中有Na2CO3 |
静置后,向上层清液滴加酚酞试液 | 溶液变红 | 白色物质中有Na2O |
甲组结论:白色固体为Na2O和Na2CO3的混合物
乙组方案:
取5.3克白色固体样品进行下列操作:
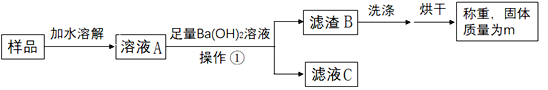
(1)操作①是_____。
(2)Ba(OH)2溶液必须足量的目的是_____。
该组同学测得m=9.85克,结合样品质量进行分析,最终得出结论:白色固体为Na2CO3。
(实验反思)
(1)为何甲、乙两组所得结论不相符,某同学分析后指出甲组方案不科学,应该将甲组方案中的Ba(OH)2溶液改为_____溶液才合理。
(2)钠在二氧化碳中燃烧的化学方程式为_____。
(拓展应用)
实验室里钠等金属因燃烧引发火灾时,可以选择的灭火方式有_____。
A 用水浇灭 B 用液态二氧化碳灭火器 C 撒沙土盖灭