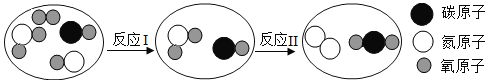
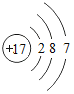
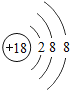
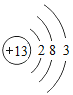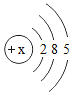题目内容
【题目】孔雀石是冶炼金属铜的主要原料,其主要成分是Cu2(OH)2CO3〔可看成是Cu(OH)2CuCO3〕,还含少量氧化铁和二氧化硅(不溶于水,也不与酸反应).以下为“湿法炼铜”并制备其它副产品氯化钠和铁红(氧化铁)的工业流程.
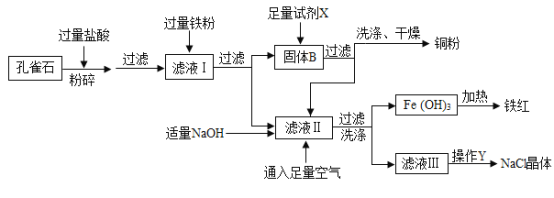
资料:
①Cu2(OH)2CO3与盐酸反应生成氯化铜、水和二氧化碳气体;
②铁能与氯化铁溶液反应,反应方程式为2FeCl3+Fe=3FeCl2
③氢氧化亚铁易被氧气氧化,反应方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3
回答下列问题:
(1)实验室在获取NaCl晶体的操作Y中,使用的仪器有:铁架台、玻璃棒、酒精灯、___;
(2)写出盐酸与Cu2(OH)2CO3反应的化学方程式:_______________________________;
(3)在滤液Ⅰ中加入过量铁粉,搅拌至充分反应,其中发生的置换反应有______个;
(4)滤液Ⅱ的溶质为:_______________________; 试剂X 是________________;
(5)在洗涤、干燥获取铜粉时,洗涤的目的是_____________________________________
(6)孔雀石也可以制取CuSO4·xH2O,现测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.4g硫酸铜晶体,加热会使结晶水失去,当加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______(计算结果精确到0.1)。
【答案】蒸发皿 Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ 2 HCl、FeCl2 稀盐酸 洗去铜表面附着的杂质 4.4
【解析】
(1)实验室在获取NaCl晶体的操作Y中,主要是蒸发,使用的仪器有:铁架台、玻璃棒、酒精灯和蒸发皿。
(2)Cu2(OH)2CO3与盐酸反应生成氯化铜、水和二氧化碳气体,反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑。
(3)Cu2(OH)2CO3与盐酸反应生成氯化铜、水和二氧化碳气体,氧化铁和稀盐酸反应生成氯化铁和水,二氧化硅和稀盐酸不反应,再经过过滤,得到的滤液Ⅰ中含有氯化铜和氯化铁,在滤液Ⅰ中加入过量铁粉,铁和氯化铜反应生成氯化亚铁和铜,和稀盐酸反应生成氯化亚铁和氢气,都属于置换反应,铁能与氯化铁溶液反应生成氯化亚铁,属于化合反应,因此发生的置换反应有2个。
(4)由(3)可知,滤液Ⅱ的溶质是氯化亚铁,固体B是剩余的铁和反应生成的铜,因此试剂X是稀盐酸,稀盐酸和铁反应生成氯化亚铁,铜不反应过滤洗涤后,得到铜。
(5)在洗涤、干燥获取铜粉时,洗涤的目的是洗去铜表面附着的杂质。
(6)根据题意有: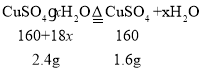
![]()
解得x![]() 。
。

 阅读快车系列答案
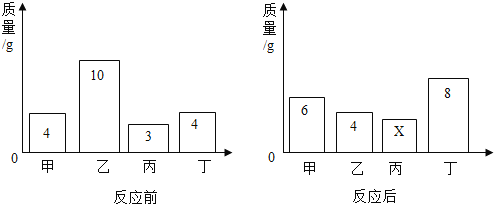
阅读快车系列答案【题目】某研究性学习小组称取含NaCl的Na2CO3固体25 g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到 8.8 g CO2气体。
(1)计算原固体中Na2CO3的质量分数____________和消耗稀盐酸的总质量____________(写出计算过程)。
(2)下表为研究性学习小组向上述配制的混合液中分三次逐滴加入(边加边振荡)稀盐酸后所记录的部分数据。经查阅资料知Na2CO3与HCl反应可以分两步进行:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑。
①请完成表格中未填的部分。
实验次数 | 每次产生的CO2的质量/g |
第一次先逐滴滴加稀盐酸100 g | ________ |
第二次再逐滴滴加稀盐酸100 g | 8.8 |
第三次再逐滴滴加稀盐酸100 g | 0 |
②根据表中数据在坐标系中画出CO2的质量(纵坐标)与所加入稀盐酸的质量(横坐标)的关系图________。
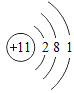
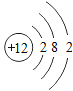
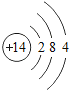
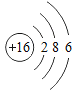
【题目】下表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)表中磷原子的核电荷数x=____.
(2)在化学反应中,每个铝原子失去____个电子形成铝离子.
(3)镁元素与氯元素形成的化合物的化学式为____
(4)上述元素在周期表中处于同一周期的原因是它们原子的____相同.