��Ŀ����
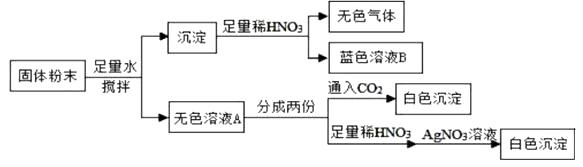
����Ŀ��ij�о���ѧϰС������˲ⶨ���Na2CO3����Ʒ������ֻ��NaCl���ʣ���Na2CO3����������ʵ�鷽��������������ǵ�̽�������ش��������⣺��������ԭװ���ڿ�����Ӱ�죩 ��A��ͬѧ�������ͼ1��ʵ��װ�ã�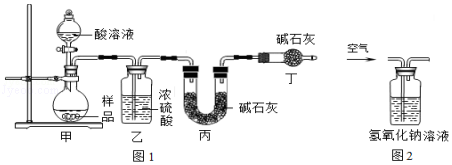
��1��ʵ��ʱ����װҩƷǰ����װ����ͼ�������� ��
��2��װ���ҵ���������
��3��װ�ö��������� �� ������ĸ��
A.����Na2CO3������Һ��Ӧ����CO2
B.��ֹ�����ж�����̼��ˮ��������װ�ñ���
C.���������̼
��4��ʵ��������μ�����Һ���ٶȹ��죬�ᵼ�²����Ʒ��̼���Ƶ������������ƫ��ƫС������Ӱ�족����
��5��B��ͬѧ��ΪA��ͬѧ�ķ����������⣬��ʹ�����淶���ⶨ���Ҳ��ƫ�ͣ������� �� Ӧ�ý�װ�ü���˫�����������������������ڼ����������ͼ2װ�ã�ʵ�������ͨ��һ��ʱ�������Ŀ���� �� ����NaOH��Һ�������� �� ��û��ͼ2װ�ã�ֱ��ͨ���������ᵼ�²�ý�����ƫ��ƫС������Ӱ�족����
��6������Ϊʵ��ʱ���������Һ��������ϡ���ᡱ��ϡ���ᡱ����
��7����С��ͬѧ��ȡ��Ʒ11.0g�����ձ��У�������ʵ�鷽������ʵ�飮 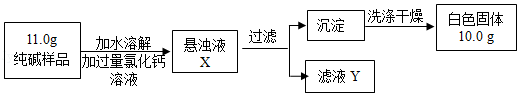
��1 ����ҺY�к��е�����������д��ѧʽ����
��2 ��֤��CaCl2�ѹ����ķ���������д��ĸ��ţ���Ȼ��۲������жϣ�
A����������ҺX�����ϲ���Һ�м����μ������Ȼ�����Һ
B��ȡ������ҺY���Թ��У��μ��Ȼ�����Һ
��3 ���������û��ϴ�Ӳ��������̼���������������ƫ��ƫС������Ӱ�족����
��4 ��ͨ�������ṩ�����ݼ������Ʒ��̼���Ƶ���������Ϊ �� ��д��������̣����������0.1%��
���𰸡�
��1�����װ��������
��2�����ն�����̼�е�ˮ����
��3��B
��4��ƫС
��5����CO2��������ƿ�ڣ�����Ӧ���ɵ�CO2ȫ�����뵽��װ���У���ȥͨ������еĶ�����̼��ƫ��
��6��ϡ����
��7��NaCl��CaCl2��A��ƫ������Ʒ��̼���Ƶ�����Ϊx��
Na2CO3+CaCl2= | CaCO3��+2NaCl |
106 | 100 |
x | 10.0g |
![]() =
= ![]() ��
��
x=10.6g
̼���Ƶ���������Ϊ�� ![]() ��100%=96.4%��
��100%=96.4%��
���������⣺��1��ʵ��ʱ����װҩƷǰ����װ����ͼ�����������װ�������ԣ� ������װ�������ԣ���2��װ���ҵ����������ն�����̼�е�ˮ������
������ն�����̼�е�ˮ��������3��װ�ö��������Ƿ�ֹ�����ж�����̼��ˮ��������װ�ñ��У�
��ѡ��B����4��ʵ��������μ�����Һ���ٶȹ��죬�ᵼ�¶�����̼���ܱ���װ����ȫ���գ��Ӷ��ᵼ�²����Ʒ��̼���Ƶ���������ƫС��
���ƫС����5��B��ͬѧ��ΪA��ͬѧ�ķ����������⣬��ʹ�����淶���ⶨ���Ҳ��ƫ�ͣ���������CO2��������ƿ�ڣ�
Ӧ�ý�װ�ü���˫�����������������������ڼ����������ͼ2װ�ã�ʵ�������ͨ��һ��ʱ�������Ŀ���ǽ���Ӧ���ɵ�CO2ȫ�����뵽��װ���У�
����NaOH��Һ�������dz�ȥͨ������еĶ�����̼��
��û��ͼ2װ�ã�ֱ��ͨ������������еĶ�����̼�ܱ���װ�����գ���ᵼ�²�ý��ƫ��
�����CO2��������ƿ�ڣ�����Ӧ���ɵ�CO2ȫ�����뵽��װ���У���ȥͨ������еĶ�����̼��ƫ��6������Ϊʵ��ʱ���������Һ����� ϡ���ᣨ�ϡ���ᡱ��ϡ���ᡱ������1����ҺY�к��е����������ʺͷ�Ӧ���ɵ�NaCl��������CaCl2 ��
���NaCl��CaCl2 �� ��2��֤��CaCl2�ѹ����ķ����ǣ���������ҺX�����ϲ���Һ�м����μ������Ȼ�����Һ��
��ѡ��A����3�����û��ϴ�ӳ������ᵼ�²ⶨ�ij�������ƫ�����̼������������ƫ��
���ƫ��4������Ʒ��̼���Ƶ�����Ϊx��
Na2CO3+CaCl2= | CaCO3��+2NaCl |
106 | 100 |
x | 10.0g |
![]() =
= ![]() ��
��
x=10.6g
̼���Ƶ���������Ϊ�� ![]() ��100%=96.4%��
��100%=96.4%��
���96.4%��
�����㾫����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ����ǽ����ĸ�������Ҫ֪��ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�ȣ�

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�����Ŀ������þ��ҽҩ����������ҵӦ�ù㷺������þ����Ҫ�ɷ�ΪMgCO3 �� ������FeCO3 �� �������ʲ��ܣ�Ҳ���μӷ�Ӧ��Ϊԭ���Ʊ��ߴ�����þ��ʵ��������ͼ1�� 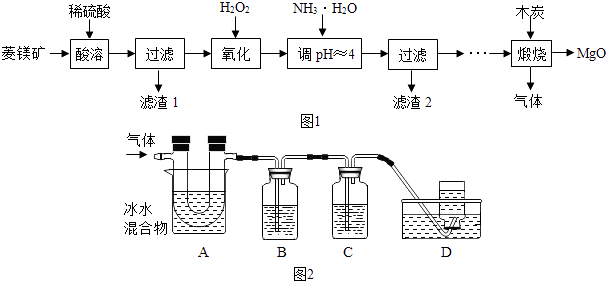
���ϣ��ٲ�ͬ�������������pH��Χ��
�������� | Fe��OH��3 | Mg��OH��2 |
��ʼ������pH | 1.5 | 8.6 |
��ȫ������pH | 3.2 | 11.1 |
�����ڳ�������һ�ֵ���ɫ���壬����۵�ԼΪ115.2�棬�е�ԼΪ444.7�棻
�۸��������Һֻ����SO2 �� ������CO2��
�ܼ���Һ������SO2 �� ������CO2 ��
�Իش��������⣺
��1��MgCO3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ ��
��2������H2O2Ŀ���������������½�FeSO4������Fe2��SO4��3 �� ͬʱ����ˮ��������Ӧ�Ļ�ѧ����ʽΪ ��
��3���Ӱ�ˮ������Һ��pHԼΪ4��Ŀ���� �� ��Ӧ�Ļ�ѧ����ʽΪ ��
��4�����չ��̴������·�Ӧ�� 2MgSO4+C ![]() 2MgO+2SO2��+CO2��
2MgO+2SO2��+CO2��
MgSO4+C ![]() MgO+SO2��+CO��
MgO+SO2��+CO��
MgSO4+3C ![]() MgO+S��+3CO��
MgO+S��+3CO��
������ͼ2װ�ö����ղ�����������зֲ����ջ��ռ���������ÿ����Ӧ����ȫ���У�
��A�������ǣ������ܱڳ���ɫ���壻
��B��ʢ�ŵ���Һ������������ĸ����ʵ������Ϊ��
a��Ca��OH��2 ��Һ b��Na2CO3 ��Һ c��ϡ���� d��KMnO4��Һ
��D���ռ������������ѧʽ����