题目内容
【题目】氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3 , 含少量FeCO3 , 其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如图1: 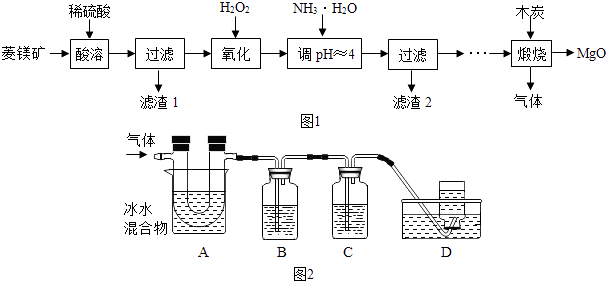
资料:①不同氢氧化物沉淀的pH范围:
氢氧化物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 8.6 |
完全沉淀的pH | 3.2 | 11.1 |
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2 , 不吸收CO2;
④碱溶液既吸收SO2 , 又吸收CO2 .
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为 .
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3 , 同时生成水,发生反应的化学方程式为 .
(3)加氨水调节溶液的pH约为4的目的是 , 反应的化学方程式为 .
(4)煅烧过程存在以下反应: 2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
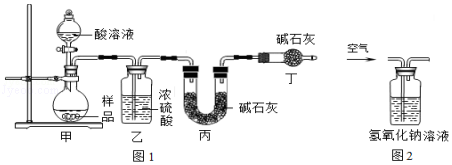
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现色固体;
②B中盛放的溶液可以是(填字母),实验现象为;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是(填化学式).
【答案】
(1)MgCO3+H2SO4═MgSO4+CO2↑+H2O
(2)2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O
(3)控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀;Fe2(SO4)3+6NH3?H2O=2Fe(OH)3↓+3(NH4)2SO4
(4)黄;d;紫红色高锰酸钾溶液颜色褪去;CO
【解析】解:(1)碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为:MgCO3+H2SO4═MgSO4+CO2↑+H2O;故填:MgCO3+H2SO4═MgSO4+CO2↑+H2O;(2)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁,同时生成水;故填:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O;(3)由题干中的不同氢氧化物沉淀的pH范围可知,pH约为4时,发生的是氨水与硫酸铁反应生成硫酸铵和氢氧化铁沉淀,此时氨水没有与硫酸镁反应;故填:控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀;Fe2(SO4)3+6NH3H2O=2Fe(OH)3↓+3(NH4)2SO4;(4)①反应的产物中含有二氧化硫、二氧化碳、一氧化碳和硫的蒸气,通过冰水混合物后,由于硫的熔点约为115.2℃,故硫的蒸气变成了固态的硫,故填:黄;②用吸收混合气体中的二氧化硫,根据题干信息可知,应该选择高锰酸钾溶液,二氧化硫能使高锰酸钾溶液的颜色褪去;故填:d;紫红色高锰酸钾溶液颜色褪去;③混合气体通过A除去了硫,通过B除去了二氧化硫,经过C中的碱溶液除去了二氧化碳,最后收集到的气体是一氧化碳,故填:CO.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案