��Ŀ����
����Ŀ����ȤС��ͬѧ����þ���ڿ����о��ñ�����ڣ�ͬѧ�Ƕ�þ����ڵ��������������������ص�̽����

��һ��þ�����������̽��
���������ϣ������£��������ƣ�Na2SO3������O2�������Ϸ�Ӧ��
����������裩�����£�þ����ڿ�����O2��CO2��ˮ�����йء�
������ʵ�飩ͨ��������þ���Ӵ������ʣ�������ͼװ�ã�þ������Ϊ3cm���Թ��ݻ�20mL�����ֱ��������5��ʵ�飬�������۲�20�졣
��� | ��Ҫʵ����� | ʵ������ |
1 | �ȳ�����NaOHŨ��Һϴ�ӹ��Ŀ����ټ���2mLŨ���� | þ��ʼ�������Ա仯 |
2 | ����2mLNaOHŨ��Һ | þ��ʼ�������Ա仯 |
3 | �ȼ���2mLŨ������ͨ��Լ4mLCO2 | þ��ʼ�������Ա仯 |
4 | �ȼ���4mL����Na2SO3��Һ�ٳ���CO2 | þ��ʼ�������Ա仯 |
5 | �ȼ���2mL����ˮ��ͨ��Լ4mLCO2 | þ����3�쿪ʼ�����20��ȫ����� |
����������ۣ�
��1��ʵ��1��2�У�NaOHŨ��Һ��������_____���û�ѧ����ʽ��ʾ����
��2��ʵ��3�У��Թ��ڵ�������Ҫ����CO2��_____��
��3���ó���þ�����һ����CO2�й������ۣ����ݵ�����ʵ����_____�����ţ���
��4����������ʵ�飬��ȤС��ͬѧ�ó����ۣ�þ�������ɫ���ʵ��γ���_____�йء�
����˼�����ۣ�
��5���ڲ��������ʱ��ͬѧ����Ϊþ�������N2�أ���������_____��
��������þ����ں��������̽��
��ȤС��ͬѧ�������ϣ��˽þ������ĺ�ɫ������һ�ֻ���������Ҫ�ɷּ�ʽ̼��þ�ɱ�ʾΪa Mg(OH)2��b MgCO3��c H2O��
���������ϣ���Mg(OH)2��MgCO3�����ֽ⣬�����ɶ�Ӧ�����������
�ڼ�ʯ����CaO��NaOH�Ĺ������
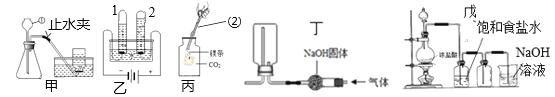
������ʵ�飩��ȤС��ͬѧΪ��һ��ȷ����ʽ̼��þ��ɣ���ȡ����ļ�ʽ̼��þ����18.2g��װ��Ӳ�ʲ����ܣ�������ͼ��ʾװ�ý���ʵ�飨����װ��A��C��D����װҩƷ����������
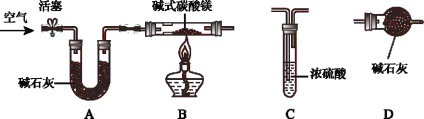
����һ������A��B��������ͨ�������
���������ȼ�ƾ��ƣ���������װ��A��B��_____��_____������C������D������
����������װ��B�й�����ȫ��Ӧ��ֹͣ���ȣ�����ͨ�������ֱ����ȴ����Ӧǰ��������װ�ú����ʵ������������������±���
��Ӧǰ | ��Ӧ�� | |
C���Թܺ���ʢ��Һ | 45.0g | 48.6g |
D������ܺ��� | 75.8g | 82.4g |
����������ۣ�
��1�������������У�����Ӧ��������ͨ�������Ŀ����_____��дһ������
��2�������������ݾ�ȷ��ͨ������ɵã��ü�ʽ̼��þ��a:b:c=_____��
��3����ͬѧ��������������������װ�õ���ĩ��Ӧ�ٽ�һ��װ�м�ʯ�ҵ�װ�ã������Ľ���Ŀ����_____��
���𰸡�2NaOH+CO2=Na2CO3+H2O ������O2�� 2��5 H2O��CO2��O2 �����Ļ�ѧ���ʲ����ã������º��Ѻ�Mg��Ӧ C D ��������װ���е�H2O��CO2��������װ��C��D�У�ʹ���ɵ�����ȫ�������� 1��3��3 ��ֹ����������װ��D�У�Ӱ��D�����صIJⶨ
��������
��һ��[���������]
��1���������ƿ����������̼��Ӧ���ʿ��������տ����еĶ�����̼����ʵ��1��2�У�NaOHŨ��Һ�����������ն�����̼���仯ѧ����ʽΪ��2NaOH+CO2=Na2CO3+H2O�����2NaOH+CO2=Na2CO3+H2O
��2��ʵ��3�м�����Ũ���ᣬ�����в�����ˮ������������4mLCO2��������Ҫ���뷴Ӧ��������O2��CO2�����������O2��
��3��Ҫ֤��þ�������Ҫ������̼����Ҫ�������������߱���ʵ����ֻȱ�ٶ�����̼��ʵ����գ����ѡ���2��5��ʵ�飻���2��5
��4�����ݶ��յĽ��������֪��þ�������H2O��CO2��O2�йأ����H2O��CO2��O2
[��˼������]
��5�����ڵ����Ļ�ѧ���ʲ����ã������º��Ѻ�Mg��Ӧ������ڲ��������ʱ��ͬѧ����Ϊþ�������N2�أ���������Ļ�ѧ���ʲ����ã������º��Ѻ�Mg��Ӧ
������[����ʵ��]
�����������ʵ���ԭ������ʽ̼��þ�ֽ����H2O��CO2����������ռ�����������ʱ����Ũ��������H2O���ü�ʯ������CO2�����C��D
[���������]
��1��������Ҫȷ�ⶨˮ�����Ͷ�����̼����������������������У�����Ӧ��������ͨ�������������װ���е�H2O��CO2��������װ��C��D�У�ʹ���ɵ�����ȫ�������գ������������װ���е�H2O��CO2��������װ��C��D�У�ʹ���ɵ�����ȫ��������
��2������Ŀ�е����ݿ�֪������m(H2O)48.6g-45.0g=3.6g������m(CO2)82.4g-75.8g=6.6g������(MgO)18.2g-3.6g-6.6g=8g�����Լ����H2O��CO2��MgO�ķ��Ӹ�������4:3:4�����ݼ�ʽ̼��þ�ֽ�Ļ�ѧ����ʽΪ��aMg(OH)2��bMgCO3��cH2O![]() (a+b)MgO+bCO2��+(a+c)H2O��֪����a+b����b����a+c��=4��3��4�����a��b��c=1��3��3�����1��3��3
(a+b)MgO+bCO2��+(a+c)H2O��֪����a+b����b����a+c��=4��3��4�����a��b��c=1��3��3�����1��3��3
��3��Ϊ�˷�ֹ����������װ��D�У�Ӱ��D�����صIJⶨ����Ҫ���������������װ�õ���ĩ��Ӧ�ٽ�һ��װ�м�ʯ�ҵ�װ�ã������ֹ����������װ��D�У�Ӱ��D�����صIJⶨ

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д�