题目内容
【题目】如图为优盘的外观和内部结构示意图。
(1)图中含有的金属材料是_____(填1种,下同)。
(2)利用铝合金做保护套的材料与用铁相比具有的优点是_____(填一点即可)。
(3)将铜加工成铜箔基板利用的铜的性质是_____。
(4)闪存芯片通常用高纯硅(纯度高达99.99%以上的Si单质)做原料。工业上利用碳与SiO2反应得到粗硅:再在粗硅中通入Cl2,得到SiCl4;最后在高温的条件下,让SiCl4与氢反应,得到高纯硅和一种化合物。请写出由SiC14得到高纯硅的化学方程式_____。

【答案】铜或铝合金 质轻(或硬度大,耐腐蚀等) 延展性 SiCl4+2H2![]() Si+4HCl
Si+4HCl
【解析】
(1)金属材料包括纯金属单质以及它们的合金,铜和铝合金属于金属材料;
(2)铝铁合金与铁相比具有的优点是质轻、硬度大,耐腐蚀等;
(3)铜具有良好的延展性,所以可将铜加工成铜箔;
(4)在高温的条件下,SiCl4与氢气反应,得到高纯硅和氯化氢气体,所以反应的化学方程式为:SiCl4+2H2![]() Si+4HCl。
Si+4HCl。

 全能测控一本好卷系列答案
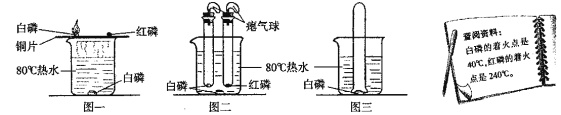
全能测控一本好卷系列答案【题目】某校兴趣小组用氯酸钾制取氧气,请按下面要求计算。
(1)取氯酸钾和二氧化锰的混合物一定量放入大试管中加热,加热至不再有气体产生为止,共收集到氧气 4.8g,求混合物中氯酸钾的质量______(计算结果精确到 0.1g)。
(2)若将一定质量的氯酸钾加热,有关物质质量与反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
O2 质量/g | 2.4 | 4.8 | 7.2 | 9.6 | 9.6 |
剩余固体质量/g | 22.1 | 19.7 | m | 14.9 | 14.9 |
其中 m=_____;t3时剩余固体中含有的物质是_____(填化学式)。
(3)若将(1)中氯酸钾平均分成两份,一份加 入 1g 二氧化锰,另一份不加,分别放入试管中,同时、同温度加热至充分反应,请在图象上画出产生O2的曲线______。