题目内容
【题目】端午节是中国传统节日,自古有吃粽子,赛龙舟,挂艾草,喝雄黄酒等习俗。
I.粽子:粽子是端午节的传统美食,其中鲜肉粽子的用料讲究,除了糯米,还有猪肉、蛋黄、食用盐、鸡精、白酒、植物油等,味道香糯可口,食之唇齿留香。
(1)粽子中的糯米富含的营养素是______。
(2)小海同学的午餐是鲜肉粽子,从营养均衡的角度来看,还需增加的食物是______。
A 馒头 B 鸡腿 C 青菜
(3)制作粽子的过程中,下列做法错误的是______。
A 因为粽子经过长时间高温烹煮,所以可用霉变的糯米洗净后制作
B 为使粽叶翠绿鲜亮,可用蓝色的硫酸铜溶液浸泡
C 用棉纱线捆扎包裹粽子
II.龙舟:制作龙舟常用樟木、桧木,现今也有用玻璃钢来制作,既环保又方便。

(4)樟木、桧木由复杂的多种有机物构成,如纤维素、半纤维素,木质素。其中纤维素______(填“属于”或“不属于”)有机高分子化合物。
(5)玻璃钢属于______材料(填序号)。
A 无机材料 B 合成材料 C 复合材料
III.雄黄酒:雄黄酒是用研磨成粉末的雄黄泡制的白酒或黄酒。古语曾说“饮了雄黄酒,病魔都远走”。雄黄的主要化学成分是硫化砷,如As4S4。雄黄加热后会转变为砷的氧化物,也就是剧毒品砒霜。从现代医学角度来看可能会对人体造成危害,不适宜食用。
(6)请写出+3价砷的氧化物的化学式______。
(7)用糯米酿制黄酒时,在酶的作用下,淀粉水解为葡萄糖,葡萄糖又在酶的作用下转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式______。
【答案】糖类 C AB 属于 C As2O3 C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
【解析】
(1)粽子中的糯米富含淀粉,淀粉属于糖类,粽子中的糯米富含的营养素是糖类;
(2)糯米中富含糖类、猪肉富含油脂和蛋白质、蛋黄富含无机盐和蛋白质,所以还应补充维生素。馒头富含糖类、鸡腿富含蛋白质、青菜富含维生素。从营养均衡的角度来看,还需增加的食物是青菜;故选C;
(3)A 霉变的糯米中含有黄曲霉素,洗净、高温烹煮都不能除去,故A错误;
B 铜离子(Cu2+)属于是重金属离子,有毒,危害人体健康。粽叶不能用蓝色的硫酸铜溶液浸泡,故B错误;
C 棉线无毒,可用棉纱线捆扎包裹粽子,故C正确。故选AB;
(4)纤维素属于有机高分子化合物。
(5)玻璃钢是由塑料和玻璃纤维复合而成的,属于复合材料。故选C;
(6)砷元素(As)的+3价的氧化物,氧元素显-2价,根据化合物中各元素化合价代数和为零,其化学式为:As2O3;
(7)葡萄糖在酶的作用下转化为乙醇和二氧化碳,反应的化学方程式为:C6H12O6![]() 2C2H5OH+2CO2↑。
2C2H5OH+2CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】结合下图回答下列问题:
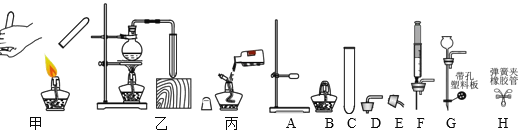
(1)仪器C的名称是______;
(2)甲、乙、丙三个操作正确的是____ ;选择其中一个错误的操作进行改正:____。
(3)气体的制取是重要实验技能。
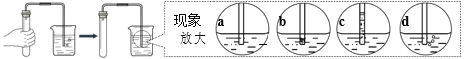
①某同学选择C、D组成发生装置制取氢气,并采用下图所示方法检査装置的气密性, 若装置的气密性良好,则松手一段时间后,烧杯内导管处的现象(画圈部分)是_____(填现象代号)。
②实验室用加热高锰酸钾制取氧气,应选择_______组成发生装置(填代号,下同);反应方程式为______。为了研究用向上排空气法和排水法收 集的氧气浓度是否有差异,某化学学习小组做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,并使用传感器测定收集到的氧气浓度,数据见下表。
收集方法 | 向上排空气法 | 排水法 | ||||
O2浓度/% | 79.6 | 79.7 | 79.8 | 90.0 | 89.8 | 89.3 |
O2平均浓度/% | 79.7 | 89.7 | ||||
Ⅰ:用排水法收集氧气时,以观察到____为氧气集满的标准;
Ⅱ:向上排空气法收集到的氧气浓度只有 80%左右,下列说法错误的是_____。
A 加热高锰酸钾固体产生氧气的浓度只有 80%左右
B 氧气的密度略大于空气的密度,无法将空气排尽
C 当观察到带火星木条伸到瓶口验满,木条复燃时,集气瓶内还有剩余空气
③实验室用电石(主要成分为 CaC2)和饱和 NaCl 溶液制取乙炔(C2H2)可燃性气体, 该反应猛烈,为了获得平稳气流,应选_____组成发生装置。用操作甲检验
乙炔的纯度时,产生尖锐爆鸣声,说明收集气体__________。
(4)下图为某化学小组的同学设计的研究氢氧化钠性质的趣味实验(实验前止水夹 K1、K2、K3 均关闭)。
实验过程:
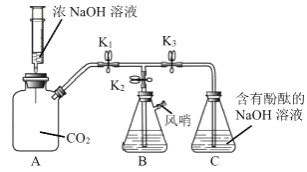
a向下推注射器,将氢氧化钠浓溶液注入瓶中。
b 打开K1和K3,C中部分 液体流入A。
c关闭K1,打开K2,风哨鸣叫,B中部分液体流入C。
①实验过程b中C中部分液体倒吸入A的原因是____(用化学方程式表示)。
②若A中溶液的溶质换成Ba(OH)2,则注液时产生现象是____。
【题目】兴趣小组同学发现镁条在空气中久置表面会变黑,同学们对镁条变黑的条件及生成物进行了相关的探究。

(一)镁条变黑条件的探究
(查阅资料)常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
(猜想与假设)常温下,镁条变黑可能与O2、CO2、水蒸气有关。
(进行实验)通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mLCO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mLCO2 | 镁条第3天开始变黑至20天全部变黑 |
(解释与结论)
(1)实验1和2中,NaOH浓溶液的作用是_____(用化学方程式表示)。
(2)实验3中,试管内的气体主要含有CO2、_____。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是_____(填编号)。
(4)根据上述实验,兴趣小组同学得出结论:镁条表面黑色物质的形成与_____有关。
(反思与评价)
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是_____。
(二)对镁条变黑后生成物的探究
兴趣小组同学查阅资料,了解到镁条表面的黑色物质是一种混合物,其中主要成分碱式碳酸镁可表示为a Mg(OH)2·b MgCO3·c H2O。
(查阅资料)①Mg(OH)2、MgCO3受热易分解,各生成对应的两种氧化物;
②碱石灰是CaO和NaOH的固体混合物。
(进行实验)兴趣小组同学为进一步确定碱式碳酸镁组成,称取购买的碱式碳酸镁固体18.2g;装入硬质玻璃管,按如下图所示装置进行实验(假设装置A、C、D中所装药品均足量)。
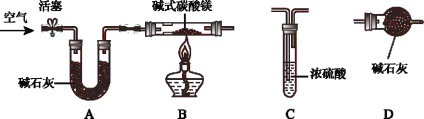
步骤一:连接A和B,打开活塞,通入空气;
步骤二:点燃酒精灯,依次连接装置A→B→_____→_____(填“C”,“D”);
步骤三:待装置B中固体完全反应后,停止加热,继续通入空气,直至冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 | |
C:试管和所盛溶液 | 45.0g | 48.6g |
D:干燥管和固体 | 75.8g | 82.4g |
(解释与结论)
(1)“步骤三”中,当反应结束后,继续通入空气的目的是_____(写一条)。
(2)假设上述数据均准确,通过计算可得:该碱式碳酸镁中a:b:c=_____。
(3)有同学提出,在“步骤二”连接装置的最末端应再接一套装有碱石灰的装置,这样改进的目的是_____。