题目内容
【题目】某学校几个兴趣实验小组利用石灰石(杂质不参与反应也不溶于水)制备轻质CaCO3并研究CaSO42H2O加热分解的产物。
(一)轻质碳酸钙的制备

已知:Ca(OH)2、NaOH和Na2CO3都显碱性,溶液可以使无色酚酞变红色。
(1)副产品氢氧化钠俗称____________(写一个即可)。
(2)该流程方案中有两个反应,产物中均出现碳酸钙,这两个反应的化学方程式分别为
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH和______________________。
(3)为验证加入Na2CO3溶液后,溶液M中的溶质是否反应完全,可取上层清液加入____(填字母)进行检验。
A碳酸钠溶液 B铁粉 C无色酚酞试液
(二)研究CaSO42H2O加热分解的产物。
利用(一)中轻质碳酸钙粉末与硫酸反应,经过一系列操作可以分离得到CaSO42H2O样品。已知:分离所得的CaSO42H2O样品中含有的CaCO3,可用盐酸除去。
(4)为了测定样品中CaSO42H2O的含量。某实验小组取10g该样品,加入足量的稀盐酸,充分反应后,产生气体的质量为0.44g,则该样品中CaSO42H2O的质量分数为________。[写出具体解题过程]
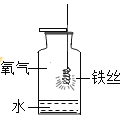
(5)为测定CaSO42H2O和CaCO3的质量比x:y,某实验小组利用如图2所示的装置(夹持仪器省略)进行实验。
查阅资料:a.CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。b.碱石灰的主要成分是NaOH和CaO的混合物。
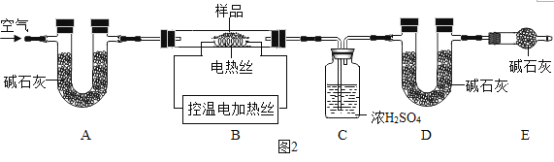
①实验前首先要_______________,再装入样品;
②装置A的作用是_____________;装置E的作用是_____________。
③现控制B装置温度900℃进行实验并采集了如下数据:a.装置C实验后增重m1g b.装置D实验后增重m2g。某同学利用采集的数据求出x:y的值,若无装置E,则实验测定结果将_______(填“偏大”、“偏小”或“无影响”)
(6)已知CaSO42H2O受热会逐步失去结晶水。取纯净CaSO42H2O(相对分子质量为172)固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图3所示。
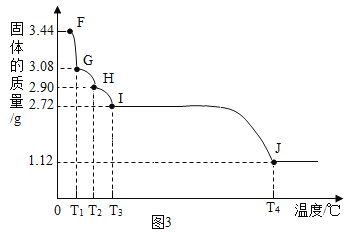
①G点固体的化学式是____________;
②在T3~T4℃温度段加热固体产生两种气体,其中一种气体有刺激性气味,则I~J段发生反应的化学方程式为____________________。
【答案】烧碱、火碱、苛性钠(写一个即可) Ca(OH)2+CO2=CaCO3↓+H2O A 90% 检查装置的气密性 除去空气中的CO2和H2O 防止空气中的CO2和H2O进入D 偏小 CaSO4H2O 2CaSO4![]() 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
【解析】
(1)氢氧化钠俗称烧碱、火碱、苛性钠;
(2)石灰石高温煅烧生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以溶液M中的溶质是否反应完全,可取上层清液加入碳酸钠溶液进行检验;
(4)设参加反应的碳酸钙的质量为x,
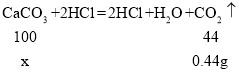
![]()
x=1g;
所以该样品中CaSO42H2O的质量分数为![]() ×100%=90%;
×100%=90%;
(5)①有气体参加的反应,实验前首先要检查装置的气密性,再装入样品;
②装置A的作用是除去空气中的CO2和H2O,防止它们影响实验结果,装置E是为了防止空气中的二氧化碳和水蒸气进入装置D,影响实验结果;
③装置E的作用是吸收空气中的水和二氧化碳,如没有装置E,则实验测定结果将偏小;
(6)①设G点固体的化学式为CaSO4xH2O,则:
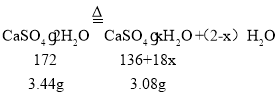
![]()
x=1;所以G点固体的化学式是CaSO4H2O;
②将T2~1400℃温度段加热产生两种气体,其中一种气体有刺激性气味,说明生成了二氧化硫气体,所以H~I段发生反应的化学方程式为:2CaSO4![]() 2CaO+2SO2↑+O2↑。
2CaO+2SO2↑+O2↑。