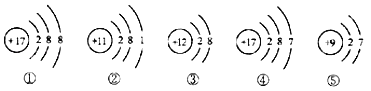
题目内容
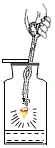
【题目】如图是铁丝在氧气中燃烧的实验。请回答:
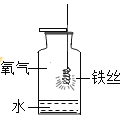
(1)反应的实验现象是________________ ;
(2)反应的化学方程式为___________ ;
(3)集气瓶中加入少量水的作用是_______________ 。
【答案】剧烈燃烧,火星四射,生成黑色固体,放出大量热 3Fe+2O2![]() Fe3O4 防止溅落的熔化物炸裂集气瓶底
Fe3O4 防止溅落的熔化物炸裂集气瓶底
【解析】
(1)铁丝在氧气中燃烧的现象是:剧烈燃烧,火星四射,生成黑色固体,放出大量热,故答案为:剧烈燃烧,火星四射,生成黑色固体,放出大量热;
(2)铁丝在氧气中燃烧生成四氧化三铁,方程式是:3Fe+2O2![]() Fe3O4,故填写:3Fe+2O2
Fe3O4,故填写:3Fe+2O2![]() Fe3O4;
Fe3O4;
(3)铁丝在氧气中燃烧时,为了防止溅落的熔化物炸裂集气瓶底,集气瓶内预留少量水,故填写:防止溅落的熔化物炸裂集气瓶底。

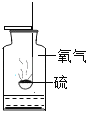
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
选项 | A | B | C | D |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:用水将集气瓶内的空气排净后,便于观察O2何时收集满 |
A.AB.BC.CD.D
【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂说明书的部分信息如图所示。现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像如下。请根据有关信息回答问题。
第1次 | 第3次 | 第4次 | |
加入盐酸的质量(g) | 20 | 20 | 20 |
剩余固体的质量(g) | 35 | a | 20 |
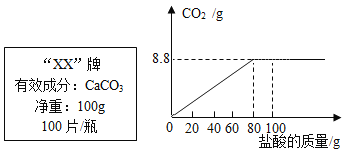
(1)该品牌补钙药剂中CaCO3的质量分数是__________,a的数值为__________。
(2)求生成氯化钙质量(写出计算过程)。__________