题目内容
【题目】硝酸钾和氯化钾的溶解度曲线如图所示
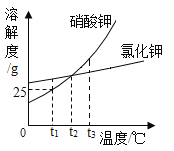
(1)t1℃时,硝酸钾的溶解度为_____g。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为_____。
(3)t2℃时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是_____。
(4)将t3℃时硝酸钾和氯化钾的饱和溶液各100g,降温至t2℃,过滤,得到溶液a和溶液b。对于溶液a和溶液b,下列说法正确的是_____。
A 都是饱和溶液 B 溶液质量a<b C 溶质质量a=b D 溶剂质量a<b E 溶质的质量分数a>b
【答案】25g 20% 蒸发溶剂 ABD
【解析】
(1)通过分析溶解度曲线可知,t1℃时,硝酸钾的溶解度为25g;
(2)t1℃时,硝酸钾的溶解度是25g,根据溶解度概念可知,100g的水中最多溶解25g硝酸钾,所以将50g硝酸钾加入到50g水中,充分溶解后,最多溶解12.5g的硝酸钾,所得溶液中溶质的质量分数=![]() ;
;
(3)t2℃时,氯化钾的溶解度受温度变化影响较小,所以氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是蒸发溶剂;
(4)硝酸钾、氯化钾的溶解度随温度降低而减小,t2℃时,硝酸钾、氯化钾的溶解度相等,将t3℃时硝酸钾和氯化钾的饱和溶液各100g分别蒸发10g水,然后降温至t2℃过滤,得到溶液a和溶液b。对于溶液a和溶液b,所以
A 都是饱和溶液,故A正确;
B t3℃时,氯化钾的溶解度小于硝酸钾的溶解度,蒸发10g水,氯化钾析出的晶体少,所以溶液质量a<b,故B正确;
C t3℃时,氯化钾的溶解度小于硝酸钾的溶解度,蒸发10g水,氯化钾析出的晶体少,溶质质量不相等,故C错误;
D t3℃时,氯化钾的溶解度小于硝酸钾的溶解度,硝酸钾和氯化钾的饱和溶液各100g,b溶液中的溶剂多,蒸发10g,水,还是b中的溶剂多,所以溶剂质量a<b,故D正确;
E a、b都是t2℃时的饱和溶液,所以溶质的质量分数a=b,故E错误。故选ABD。

 阅读快车系列答案
阅读快车系列答案【题目】如图所示是提纯粗盐的实验,粗盐中含有较多的可溶性杂质(CaCl2、MgCl2)和不溶性杂质(泥沙等),请你根据实验回答下列问题
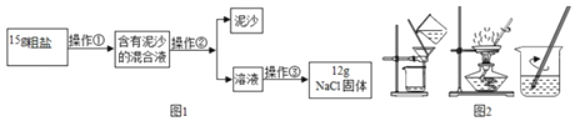
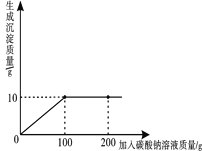
(1)实验中的操作、依次为图2中的_____;
(2)若得到的NaCl产量比实际值偏低,原因有_____;
(3)操作③利用了NaCl具有_____的性质
(4)小明是个爱学习的学生,对化学充满了兴趣,他想知道提纯后的NaCl固体是否为纯净物,请你根据所学知识帮助他完成下表。
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |
(5)写出问题(4)实验中有关的化学方程式_____;该反应基本类型是_____。
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
(查阅资料)①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
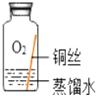
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
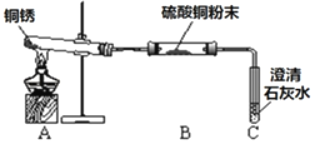
(解释与结论)依据以上现象分析,铜锈中一定含有的元素:Cu和_____。
II.探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
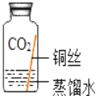
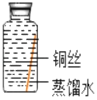
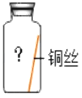
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验②和③,得出的结论是_____。
(4)为验证猜想,实验⑤的集气瓶中的气体是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)防止金属锈蚀的方法是_____(写一种)。