题目内容
有炭粉和氧化铜的黑色固体20g,加热后将生成的气体通入足量的石灰水中,气体全被吸收,产生了10g沉淀,求原混合物的组成。
C:1.2g,CuO:18.8g或CuO:16g,C:4g
解析试题分析:炭粉和氧化铜的黑色固体20g,加热反应要不恰好反应,要不炭粉过量,要不氧化铜过量,发生反应;C+ 2CuO 高温2Cu + CO2↑,生成的气体通入足量的石灰水中,方程式:Ca(OH)2 +CO2 =CaCO3↓+H2O,,沉淀质量10g即CaCO3的质量,再根据化学方程式可得以下关系式:CaCO3 ≈ CO2 ≈ C ≈ 2CuO,,即可算出
解:设参加反应C的质量为x,CuO质量为y
Ca(OH)2 +CO2 =CaCO3↓+H2O C + 2CuO 2Cu + CO2↑
2Cu + CO2↑
根据化学方程式可得以下关系式:
CaCO3 ≈ CO2 ≈ C ≈ 2CuO
100 44 12 160
10g x y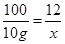
x=1.2g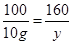
y=16g
原混合物的组成:C:1.2g,CuO:18.8g或CuO:16g,C:4g
考点:化学方程式中物质的过量的计算

练习册系列答案
相关题目
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。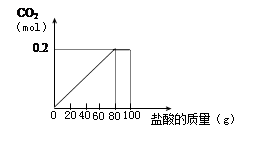
| 次数 | 第1次 | 第3次 | 第4次 |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 30 | a | 15 |
(1)石灰石样品中CaCO3的质量分数是 。
(2)第3次加入盐酸后,a为 g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)
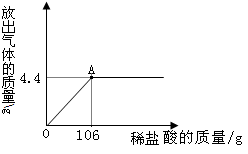

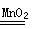 2H2O+O2↑)
2H2O+O2↑)