题目内容
在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:
取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如图所示:
(1)通过上图可知,当碳酸钠溶液质量加到 kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)此时所得溶液能否用于该校生物兴趣小组的小麦选种(选种液要求氯化钠的溶质质量分数在10%一20%之间)?请通过计算回答。
(1)15kg
(2) 14.04%,可以作为生物兴趣小组的选种液
解析试题分析:加热的碳酸钠先与盐酸反应,把盐酸反应后再用氯化钙反 应;根据图示,当加入碳酸钠溶液的质量为10kg是,溶液的PH等于7,即表示此时碳酸钠与盐酸恰好完全反应;当加入的碳酸钠溶液的质量为15kg以后,溶液的PH大于7,即表示碳酸钠溶液过量,即表示与氯化钙反应的碳酸钠溶液的质量为15-10=5kg;根据碳酸钠的质量利用化学方程式即可求出厂价反应的各物质的量。
(1)15kg
(2)解:设Na2CO3与HCl反应生成NaCl、CO2的质量分别为x1、y1,与CaCl2反应生成 NaCl、CaCO3的质量分别为x2、y2
Na2CO3+2HCl=2NaCl+CO2↑十H2O Na2CO3+CaCl2=CaCO3↓+2NaCl
106 117 44 106 100 117
10kg×21.2% x1 y1 5kg×21.2% x2 y2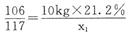
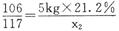
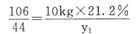
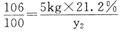
x1= 2.34kg y1=0.88kg………(3分) x2=1.17kg y2= lkg
恰好处理完时溶液的溶质质量分数= =14.04%
=14.04%
答:可以作为生物兴趣小组的选种液。
考点:根据化学反应方程式的计算

长期使用的水壶底部结有一层水垢,其主要成分是碳酸钙和氢氧化镁,为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用如图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表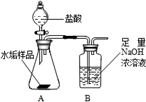
| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量 | 2.17 | 2.22 | 2.21 | |
(1)第一次实验测得数据较低的原因是___________;
(2)平均每份水垢样品中碳酸钙的质量为___________克.
 CaO+CO2 ↑。若要制取2.8吨生石灰,至少需要含杂质10%(杂质不参加反应)的石灰石多少吨?(结果保留一位小数)
CaO+CO2 ↑。若要制取2.8吨生石灰,至少需要含杂质10%(杂质不参加反应)的石灰石多少吨?(结果保留一位小数)