题目内容
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。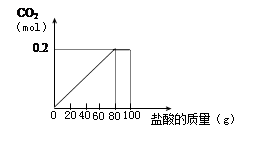
| 次数 | 第1次 | 第3次 | 第4次 |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 30 | a | 15 |
(1)石灰石样品中CaCO3的质量分数是 。
(2)第3次加入盐酸后,a为 g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)
(1)0.571(57.1%或4/7)
(2)20
(3)0.1825
解析试题分析:由表格可以知道,剩余的固体即为二氧化硅为15g,因为二氧化硅与稀盐酸不反应,所以碳酸钙为20g,质量分数为20比35等于4/7,每次加的盐酸的量都是一样的,所以消耗的碳酸钙也应该是相同的,即每次反应掉5g的碳酸钙,一共有20g碳酸钙,所以第三次共反应掉碳酸钙15g,剩余固体质量为20g,a为20g,根据化学方程式进行计算:
设需要盐酸中HClx mol
CaCO3+2HCl→CaCl2+CO2↑+ H2O
2 1
X 0.2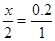
x="0.4mol"
0.4×36.5g/mol="14.6g"
14.6/80=0.1825
考点:根据化学方程式进行计算

练习册系列答案
相关题目
(6分)为测定Cu一Zn合金的组成,小华同学利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
| | 第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 1O | 10 | 20 |
| 加入硫酸的质量/g | 50 | 80 | 50 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸恰好完全反应;
(2)该合金中锌的质量为多少克?(计算结果保留一位小数)
(3)所用合金中的锌与稀硫酸恰好完全反应时所得溶液中溶质的质量分数为多少?(计算结果精确到0.1%)

 MnSO4+H2O+CO2↑)
MnSO4+H2O+CO2↑)