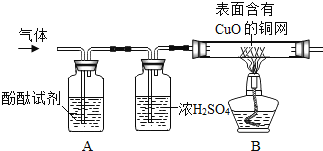
题目内容
【题目】在化学学习中,了解知识的发展历程,可以促进我们正确理解科学本质。
(1)火药起源于唐朝。制作烟花的火药中加入镁粉,是为了引燃后能看到_____。
(2)十八世纪,化学家发现某些金属与酸反应能生成一种气体,该气体被称为“会制造水的物质”。写出该气体燃烧制造水的化学方程式:_____。
(3)俄国化学家贝开托夫于1865年发表了金属活动性顺序。某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成。
①写出生成红色固体的化学方程式:_____。
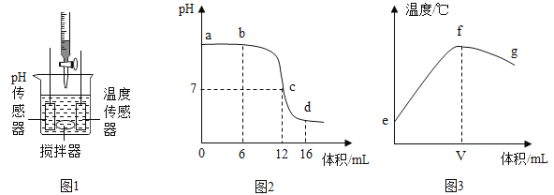
②利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示),
说明该过程_____(填“放热”或“吸热”),溶液的酸性_____(填“增强”或“减弱”);推测铝与溶液中的_____(填离子符号)反应生成无色气体_____(填物质名称)。
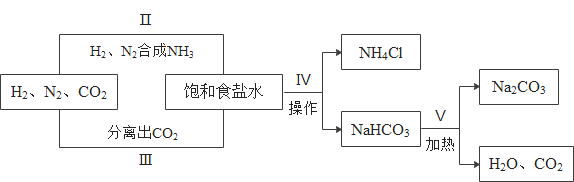
(4)粗盐提纯的步骤如下:
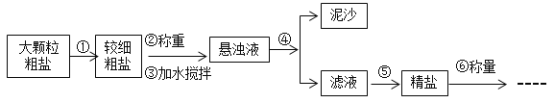
a.操作⑤中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、_____。其中玻璃棒的作用是_____。
b.实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,其可能原因是_____。
A 食盐没有全部溶解即过滤 B 蒸发时食盐飞溅剧烈
C 蒸发后,所得精盐很潮湿 D 器皿上沾有的精盐没全部转移到称量纸上
【答案】耀眼的白光 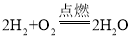 2Al+3CuCl2=3Cu+2AlCl3 放热 增强 H+ 氢气 蒸发皿 搅拌,以防止液体局部温度过高造成液滴飞溅 ABD
2Al+3CuCl2=3Cu+2AlCl3 放热 增强 H+ 氢气 蒸发皿 搅拌,以防止液体局部温度过高造成液滴飞溅 ABD
【解析】
(1)镁燃烧时发出耀眼的白光,制作烟花的火药中加入镁粉,是为了引燃后能看到耀眼的白光。
(2)金属能与酸反应生成氢气,氢气燃烧生成水,氢气燃烧的化学方程式: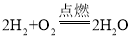
(3)金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来。某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成。
①铜是一种红色固体,生成红色固体的化学方程式:2Al+3CuCl2=3Cu+2AlCl3。
②过程中温度升高,说明该过程放热。pH值越小,溶液的酸性越强,故溶液的酸性增强;金属能与酸反应生成氢气,某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成,可推测铝与溶液中的H+反应生成无色气体氢气。
(4)a.根据题意可知,操作⑤是蒸发,根据蒸发操作和题中所给的仪器可知,还缺少的仪器是蒸发皿。其中玻璃棒的作用是搅拌,以防止液体局部温度过高造成液滴飞溅。
b.A 食盐没有全部溶解即过滤,部分食盐被滤出,会流失一部分氯化钠,所以会导致产率偏低,此选项符合题意;
B 蒸发时食盐飞溅剧烈,会使获得的食盐质量偏少,此选项符合题意;
C 蒸发后,所得精盐很潮湿,会由于含有了水分,而导致产率偏大,此选项不符合题意;
D 器皿上沾有的精盐没全部转移到称量纸上,会使获得的食盐质量偏少,此选项符合题意。故选ABD。

【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
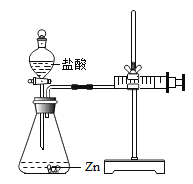
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
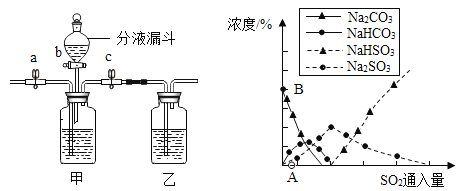
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.