题目内容
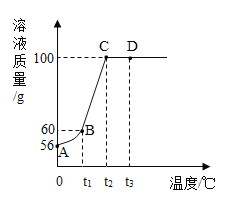
【题目】向一定质量的Na2SO4、MgSO4混合溶液中先后滴加150.0g 3.42%的稀Ba(OH)2溶液、100.0g稀H2SO4,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法不正确的是
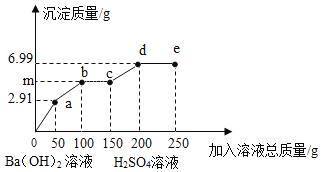
A.m=5.24
B.a点沉淀的成分为两种
C.所用稀H2SO4的质量分数为3.92%
D.向e点所得溶液中滴加紫色石蕊试液,溶液呈红色
【答案】C
【解析】
根据第一个拐点在消耗50.0g3.42%的稀Ba(OH)2溶液处,可知此段是氢氧化钡和硫酸钠以及硫酸镁反应生成硫酸钡和氢氧化镁,所以a点沉淀的成分为两种。
设生成的氢氧化镁的质量为x ,生成的硫酸钡的质量为y
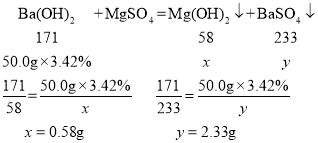
所以此时沉淀的总质量为0.58g+2.33g= 2.91g
由于50.0g氢氧化钡对应的硫酸钡是2.33g,则150.0g氢氧化钡溶液对应的硫酸钡的质量为6.99g,而加入硫酸50.0g也对应2.33g硫酸钡,所以a-b段是氢氧化钡只和硫酸钠反应,到b点时硫酸钠完全反应,之后是氢氧化钡过量。
所以m点是继续在2.91g的基础上继续生成硫酸钡,且50.0g氢氧化钡对应的硫酸钡是2.33g ,所以m=2.91g+2.33g=5.24g
由于加入硫酸50.0g也对应2.33g硫酸钡,所以设所用稀硫酸的质量分数为z
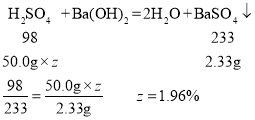
所以所用稀硫酸的质量分数为1.96%。
d点氢氧化钡恰好完全反应,所以之后是硫酸过量,即之后溶液呈酸性,所以向e点所得溶液中滴加紫色石蕊试液,溶液呈红色。
故只有C不正确。

【题目】同学们在实验室举行创新实验活动时,对防毒面具罐体內物质产生了浓厚的兴趣并对其展开了探究。
(查阅资料)防毒面具里通常有滤毒罐和生氧罐。①滤毒罐中的活性炭能滤去有毒气体,这是利用活性炭的______性。②生氧罐中装有过氧化钠生氧剂,在通常情况下,过氧化钠是一种粉末状固体,过氧化钠与水和二氧化碳都能反应,其化学方程式为![]() ,
,![]() 。
。
(提出问题)使用一段时间后,生氧罐内的固体粉末是什么?
(猜想与假设)猜想一:Na2CO3
猜想二:Na2CO3和Na2O2
猜想三:Na2CO3和NaOH
猜想四:Na 2CO3、 Na2O2和NaOH
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的水,振荡 | ____ | 不含Na2O2 |
②在步骤①所得的溶液中滴加____,振荡 | 产生白色沉淀 | 含Na2CO3 |
③在步骤②所得的溶液中滴加_____,振荡 | 溶液变红 | 含__ |
(得出结论)猜想____正确。
(交流与反思)(1)请写出步骤②中发生反应的化学方程式:_______。
(2)小红认为将步骤②③所用试剂调换也可以得出正确的结论,理由是______。