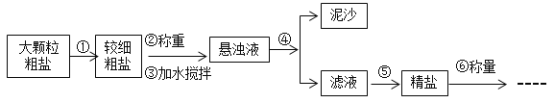
题目内容
【题目】1898年德国人首次发现空气中的氮能被碳化钙固定而生成氰氨化钙(CaCN2),为合成氨工业奠定了基础,从而促进了氨碱工业的全面发展,工业上制取纯碱的部分流程如下:
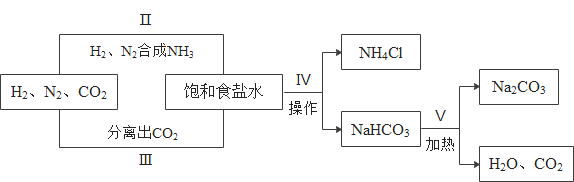
(1)氰氨化钙与水蒸气反应生成氨气和碳酸钙,该反应的化学方程式是____。
(2)碳酸氢钠只有在固态时,加热才会分解,则第IV步中操作的名称是___。
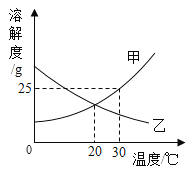
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶甲和分液漏斗中盛放的药品分别是______溶液(填化学式)、稀硫酸。
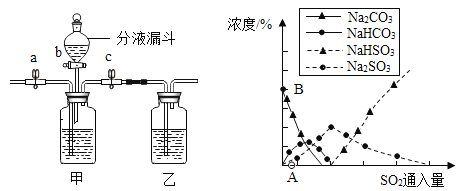
(4)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图所示。
①吸收初期(图中B点以前)反应的化学方程式为_______。
②不断通入SO2,最终产物是____。
【答案】![]() 过滤 NaOH
过滤 NaOH ![]() NaHSO3
NaHSO3
【解析】
(1)氰氨化钙与水蒸气反应生成氨气和碳酸钙,故反应的化学方程式写为:CaCN2+3H2O=CaCO3+2NH3。
(2)碳酸氢钠的溶解度较小,反应后生成的碳酸氢钠以晶体从溶液中结晶析出,将碳酸氢钠晶体从溶液中分离出来可以采用过滤的方法,故填过滤。
(3)氢气与氮气均不与氢氧化钠发生反应,而二氧化碳与氢氧化钠反应生成碳酸钠和水,所以甲瓶中成分氢氧化钠溶液来吸收二氧化碳,从而分离出氢气和氮气,然后再向甲瓶中滴加酸液与碳酸钠反应,再将二氧化碳释放出来,即甲瓶中盛放氢氧化钠溶液,其化学式为NaOH,故填NaOH。
(4)①由图可知,反应初期,溶液中碳酸氢钠与亚硫酸钠的浓度较大,说明反应是碳酸钠、水和二氧化硫反应生成碳酸氢钠和亚硫酸钠,故反应的化学方程式写为:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3;
②由图可知,反应后期溶液中亚硫酸氢钠的浓度较大,而碳酸氢钠和亚硫酸钠的度为零,所以最终的产物是亚硫酸氢钠,其化学式为,故填NaHSO3。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】“低钠盐”可以控制钠的摄入量从而防止高血压等疾病。国内某些生产厂家为改变“低钠盐”的口味,还会在“低钠盐”中加入少量的镁盐(MgSO4或MgCl2中的一种)。某兴趣小组的同学对某“低钠盐”样品中添加的镁盐的成分进行如下探究:
[提出问题]该“低钠盐”中添加了哪种镁盐?
[猜想与假设]猜想1:添加了MgCl2
猜想2:添加了MgSO4
[设计实验]
实验操作 | 实验现象 | 实验目的或结论 |
步骤1:取少量“低钠盐”充分溶解后,加入足量_____溶液 | _____。 | 除尽溶液中的镁离子 |
步骤2:取少量步骤1所得的上层清液,向其中加入适量_____溶液 | 有白色沉淀生成 | 猜想2正确 |
写出步骤2中发生反应的化学方程式_____。
[拓展与应用]若将NaCl溶液中含有的少量MgSO4除去,下列提供的试剂中,可选用的是_____ ( 填字母)。
A NaOH溶液
B BaCl2 溶液
C AgNO3溶液
D Ba(OH)2溶液
【题目】某学习小组对碳酸钠、碳酸氢钠和稀盐酸的反应进行了探究。
(1)分别在盛有少量碳酸钠(俗称________)、碳酸氢钠固体的试管中加入足量稀盐酸,观察到都剧烈反应且产生大量气泡。碳酸氢钠和稀盐酸反应的化学方程式为_______。
(提出问题)
碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?
(设计与实验)
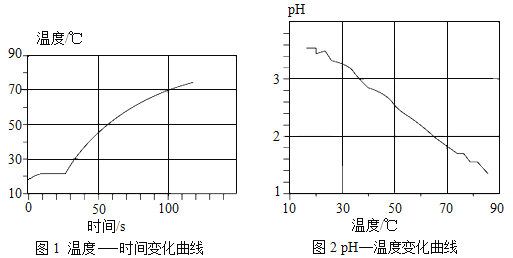
(2)甲设计的实验如图1所示,实验时,两注射器中的稀盐酸应________(填操作),观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。

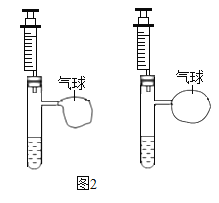
(3)乙对甲的实验提出了质疑:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过观察很难判断产生气体的快慢;
②当稀盐酸足量时,相同质量的固体,___________与稀盐酸反应生成的二氧化碳更多;他认为,应取含碳元素质量相同的碳酸钠和碳酸氢钠分别与稀盐酸反应。
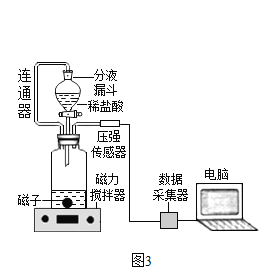
(4)小组同学在老师指导下设计了图3所示的实验。
分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液,以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,广口瓶内压强随时间变化如图4所示。
(实验结论)
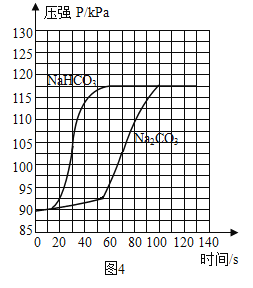
(5)分析图4所示的实验数据可得到的结论是:相同条件下,_________和稀盐酸反应产生二氧化碳较快,理由是__________。
(反思与应用)
(6)小组同学查阅资料分析实验现象和图4数据,得出碳酸钠和稀盐酸反应产生二氧化碳较慢的原因是:碳酸钠先与稀盐酸反应生成碳酸氢钠和氯化钠,反应生成的碳酸氢钠再与稀盐酸反应。
(7)通过以上探究与分析,小组同学设计了只用试管和胶头滴管鉴別碳酸钠溶液和稀盐酸的实验。
操作 | 现象与结论 |
未知溶液分別编号为a、b,取适量a于试管中,用胶头滴管逐滴滴入b并振荡 | ①若刚开始无明显现象,后随着b不断滴入产生较多气泡,则b是________; ②若立即产生大量气泡,则b是_______。 |
【题目】实验小组将澄清石灰水和碳酸钠溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
[猜想与假设]①含有NaOH;
②含有____.
③含有NaOH、Na2CO3;
④含有 NaOH、Na2CO3和Ca(OH)2。
[设计与实验]
(1)大家认为猜想_____一定不正确,其原因是_______。
(2)甲同学取滤液M样品,向其中加入足量的____,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下
实验操作 | 现象 | 结论 |
取一定量滤液M于试管中,加入__溶液 | ________ | 猜想②成立 |
相关反应的化学方程式为____。
[交流与反思]若将滤液M直接倒入下水道,对环境造成的影响是会污染水源。
(4)若假设①成立,取反应后的滤液M 100克,加入10克溶质质量分数为3. 65%的稀盐酸恰好完全反应,则滤液中溶质的质量分数是多少____?