题目内容
【题目】金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体。为确定气体的成分,进行下列实验探究。
(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是______。
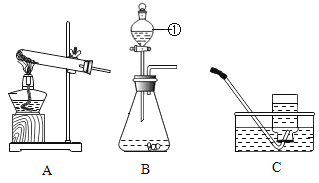
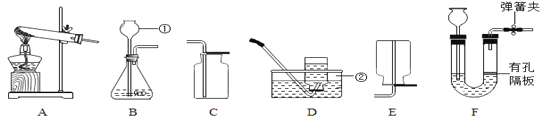
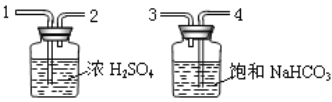
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO![]() 3Cu+N2+3H2O。于是设计了如下图实验装置:
3Cu+N2+3H2O。于是设计了如下图实验装置:
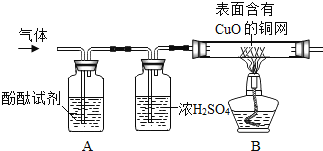
(3)现象与结论:A中观察到酚酞试剂变红色,证明有______;B中玻璃管内观察到固体表面由黑色变红色,证明有______。
(4)实验反思:①浓硫酸的作用是______。
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入酸化的______溶液中,无白色沉淀产生,则该气体中______HCl(填“有”或“无”)。
③写出Na与NH4Cl溶液反应的化学方程式______。
【答案】化学反应前后元素种类保持不变 NH3 H2 吸收氨气和水 硝酸银溶液 无 ![]()
【解析】
(1)根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Na、N、H、Cl,故生成的气体可能是HCl、NH3、H2中的一种或几种;
(3)A中观察到酚酞试剂变红色,说明有氨气生成,氨气溶于水,与水反应生成氨水,氨水显碱性,能使无色酚酞试液变红;
浓硫酸能与氨气反应,故生成的氨气被浓硫酸吸收,B中玻璃管内观察到固体表面由黑色变红色,证明有氢气生成,氢气与氧化铜在加热的条件下反应生成铜和水,故观察到固体表面由黑色变红色;
(4)①浓硫酸具有吸水性,且浓硫酸能与氨气反应,故浓硫酸的作用是:吸收水分和氨气;
②甲的设计不能证明气体中不含HCl,HCl能与硝酸银反应生成氯化银白色沉淀,且生成的沉淀不溶于硝酸,故可将气体通入酸化的硝酸银溶液中,无白色沉淀生成,说明气体中不含HCl;
③由以上分析可知,钠与氯化铵反应生成了氨气和氢气,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Na、N、H、Cl,生成物中含N、H,故生成物中还应含Na、Cl,故还生成了氯化钠,该反应的化学方程式为:![]() 。
。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】实验小组将澄清石灰水和碳酸钠溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
[猜想与假设]①含有NaOH;
②含有____.
③含有NaOH、Na2CO3;
④含有 NaOH、Na2CO3和Ca(OH)2。
[设计与实验]
(1)大家认为猜想_____一定不正确,其原因是_______。
(2)甲同学取滤液M样品,向其中加入足量的____,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下
实验操作 | 现象 | 结论 |
取一定量滤液M于试管中,加入__溶液 | ________ | 猜想②成立 |
相关反应的化学方程式为____。
[交流与反思]若将滤液M直接倒入下水道,对环境造成的影响是会污染水源。
(4)若假设①成立,取反应后的滤液M 100克,加入10克溶质质量分数为3. 65%的稀盐酸恰好完全反应,则滤液中溶质的质量分数是多少____?