题目内容
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
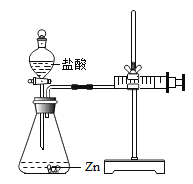
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.
【答案】Zn+2HCl=ZnCl2+H2↑>金属活动性越强,反应越剧烈通过注射器往右移动的体积测得生成氢气的体积其他条件相同时,盐酸浓度越大,反应越剧烈锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢金属与盐酸反应的剧烈程度与金属表面积大小有关分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢
【解析】
【设计探究】金属与酸的反应为置换反应,符合A(单质)+BC=C(单质)+AB,故可以实现化学方程式;
根据题中的信息解答;
得出结论:根据金属的活动性顺序,金属的活动性与反应的剧烈程度的关系是活动性较强的金属与酸反应更剧烈;
实验(2)根据注射器的作用是量取生成气体的体积解答;
得出结论:根据表中信息解答;
【反思评价】根据表中信息解答;猜想是研究反应的剧烈程度与酸的浓度有关,其它条件不变,取用的是不同浓度的足量盐酸溶液。
解:【设计探究】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式;如锌与盐酸反应:反应物为锌与盐酸,生成物为氯化锌与氢气,根据质量守恒定律,故正确书写化学方程式Zn+2HCl=ZnCl2+H2↑;放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,金属活动性Zn>Fe
得出结论:根据金属的活动性顺序,金属的活动性与反应的剧烈程度的关系是活动性较强的金属与酸反应更剧烈;
实验(2)注射器的作用是量取生成气体的体积;
得出结论:相同条件下,金属与酸反应生成氢气的剧烈程度与酸的浓度有关;
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
【拓展延伸】
金属与盐酸反应的剧烈程度可能受固体的表面积、反应物的状态、催化剂的影响;
答案:
【设计探究】Zn+2HCl=ZnCl2+H2↑;>
得出结论:活动性较强的金属与酸反应更剧烈
实验(2)量取生成气体的体积
得出结论:相同条件下,金属与酸反应生成氢气的剧烈程度与酸的浓度有关。
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢。
【拓展延伸】金属与盐酸反应的剧烈程度与金属表面积大小有关
分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢。