题目内容
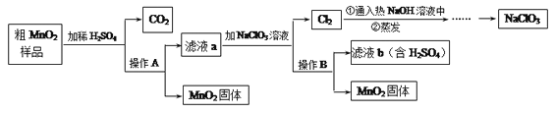
【题目】用锈蚀严重的废铜屑为原料,回收铜
资料 1:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑ Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
资料 2:回收铜的两种实验方案。
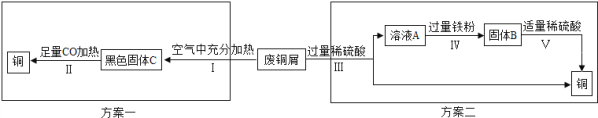
反思与评价:
(1)写出步骤Ⅳ所发生反应的化学方程式 ________ 。(任写一道)
(2)如何判断步骤Ⅴ加入的稀硫酸适量_______。
(3)理论上两种方案获得铜的质量比较:方案一 __________方案二(选填“>、=、<”)。
(4)方案二优于方案一的理由是____________(答一点)。
【答案】Fe+CuSO4=Cu+FeSO4或Fe+H2SO4=FeSO4+H2↑ 逐滴滴加稀硫酸至无气泡产生为止 = 节约能源
【解析】
(1)经分析,溶液A中有硫酸铜、硫酸,加入过量铁粉,铁与硫酸铜反应生成铜和硫酸亚铁、铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4、Fe+H2SO4=FeSO4+H2↑;
(2)步骤Ⅴ的反应是铁与硫酸反应生成硫酸亚铁和氢气,当逐滴滴加稀硫酸至无气泡产生为止,说明加入的硫酸为适量;
(3)上述两种方案中,铜元素既没有增加,也没有减少,同一份废铜屑分别通过上述两种方案最终得到的铜的质量相等;
(4)以上两种方案中,方案二优越于方案一,理由是方案二节约能源,更安全、环保。

【题目】如图是有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷,将它放在盛有沸水的烧杯上方,进行实验。
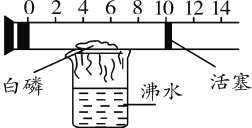
(1)在玻璃容器内还可以看到有大量_______生成,该生成物名称为__________,其化学反应的符号表达式为__________。
(2)请完成实验报告:
实验目的 | 实验现象 | 实验结论 |
测定空气中______的体积分数 | 白磷着火燃烧,活塞_______,最后停在刻度约为________ (填整数)的位置上 | 空气的成分按体积计算,氧气约占______。 |