题目内容
【题目】MnO2是一种重要的无机功能材料,粗MnO2(含有较多的MnO和MnCO3)的提纯是工业生产的重要环节。下图是某研究性学习小组在实验室中模拟工业上粗MnO2转化为纯MnO2的工艺流程。
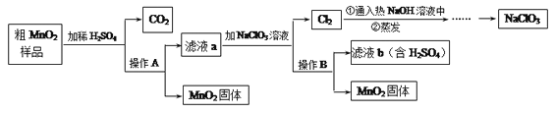
请回答下列问题:
(1)操作A的名称是____________,其中玻璃棒的作用是__________。
(2)NaClO3中氯元素的化合价为________价。
(3)写出加稀H2SO4时产生CO2 的化学方程式_______。
(4)该流程中可以循环利用的物质是H2SO4和________。
【答案】过滤 引流 +5 MnCO3+H2SO4== MnSO4+H2O+CO2![]() NaClO3
NaClO3
【解析】
(1)过滤可以分离难溶性的固体和液体组成的混合物,故填过滤;
过滤时,玻璃棒的作用是引导待滤液流进过滤器,简称引流,故填引流。
(2)NaClO3中,钠元素的化合价为+1价,氧元素的化合价为2价,化合物中,各元素的化合价的代数和为零,设氯元素的化合价为x,则+1+x+(-2×3)=0,x=+5,故填+5。
(3)由题干可知,硫酸与样品中的碳酸锰反应生成硫酸锰、水和二氧化碳,故反应的化学方程式写为:MnCO3+H2SO4=MnSO4+H2O+CO2↑。
(4)由题干分析可知,能够循环使用的物质除硫酸外,还有氯酸钠,其化学式为NaClO3,故填NaClO3。

【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸的化学名称叫甲酸,化学式为HCOOH
II.蚁酸隔绝空气并加热时会分解生成两种氧化物
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有_____元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:
猜想Ⅰ是CO2;
猜想Ⅱ是_____;
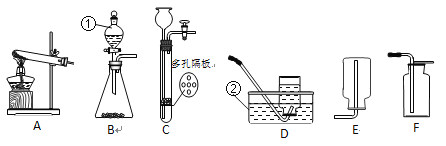
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
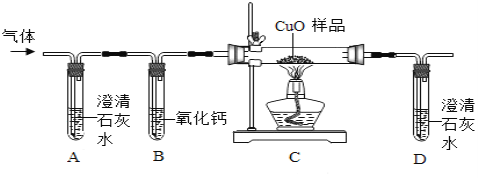
①先通N2的目的是__________;
②若实验过程中看到__________现象,则猜想Ⅰ不成立;
③装置B的作用是__________(用化学方程式表示);
④装置C中的现象为________;
[结论]甲酸受热能分解,反应的化学方程式是_________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________.
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据计算:样品中氧化铜的质量分数是多少______?(写出计算过程)