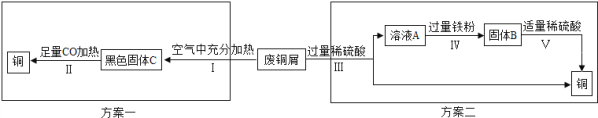
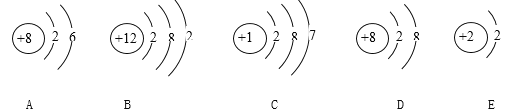
题目内容
【题目】点燃两支蜡烛,分别放在白铁皮架的两个阶梯上,把白铁皮架放在烧杯里(如图所示)。沿烧杯内壁缓缓倾倒二氧化碳。
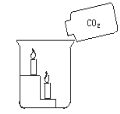
(1)向烧杯中倾倒二氧化碳时,观察到的现象是: ____________
(2)该实验说明:_____________________
(3)由上述结论可推断CO2的重要用途之一是 ___________。
【答案】烧杯中的蜡烛下面的先熄灭,上面的后熄灭 一般情况下,二氧化碳不能燃烧,也不能支持燃烧,二氧化碳的密度大于空气 灭火
【解析】
(1)向烧杯中倾倒二氧化碳时,观察到的现象是:烧杯中的蜡烛下面的先熄灭,上面的后熄灭;
(2)该实验说明二氧化碳具有的性质是:①一般情况下,二氧化碳既不能燃烧,也不能支持燃烧②二氧化碳的密度大于空气;
(3)由上述结论可推断CO2的重要用途之一是灭火。

【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸的化学名称叫甲酸,化学式为HCOOH
II.蚁酸隔绝空气并加热时会分解生成两种氧化物
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有_____元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:
猜想Ⅰ是CO2;
猜想Ⅱ是_____;
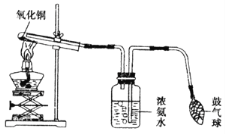
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
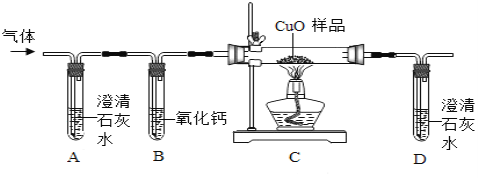
①先通N2的目的是__________;
②若实验过程中看到__________现象,则猜想Ⅰ不成立;
③装置B的作用是__________(用化学方程式表示);
④装置C中的现象为________;
[结论]甲酸受热能分解,反应的化学方程式是_________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________.
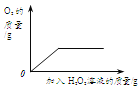
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据计算:样品中氧化铜的质量分数是多少______?(写出计算过程)