题目内容
【题目】已知A﹣H为初中常见物质,A为红棕色,是赤铁矿的主要成分,F为紫红色金属,甲是黑色固体,它们相互转化关系如图所示(反应条件和部分产物已略去).请按要求回答下列问题:
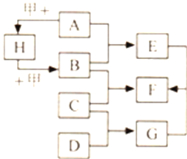
(1)写出甲的化学式___________;写出C的化学式___________.
(2)写出A+B→E的化学方程式:___________;写出E+G→F的化学方程式:________.
(3)写出H+甲→B的化学方程式:__________________________
【答案】Fe2O3 CuO Fe2O3+3CO ![]() 2Fe+3CO2 CuO+ H2SO4 == CuSO4+H2O CO2+C
2Fe+3CO2 CuO+ H2SO4 == CuSO4+H2O CO2+C![]() 2CO
2CO
【解析】
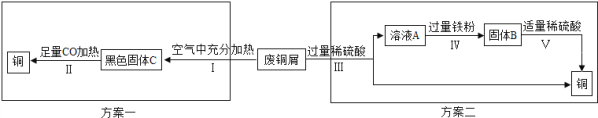
A为红棕色,是赤铁矿的主要成分,则A是氧化铁;F为紫红色金属,F可能是铜;甲是黑色固体,能与氧化铁反应生成H,H又能与甲反应生成B,且B可以与氧化铁反应,则甲是碳,H是二氧化碳,B是一氧化碳;B 与C反应能生成铜,则C是氧化铜;一氧化碳与氧化铁反应能生成铁和二氧化碳,则E是铁,E能与G反应生成铜,则G是硫酸铜;氧化铜与D反应生成硫酸铜,则D是稀硫酸。经检验,分析推断正确。
(1)由以上分析可知,甲物质的化学式为:Fe2O3; C的化学式为:CuO。
(2)由上可知,ABE分别是氧化铁、一氧化碳和铁,氧化铁与一氧化碳在加热的条件下反应生成二氧化碳和铁,反应的方程式为:Fe2O3+3CO ![]() 2Fe+3CO2。由分析可知,EGF分别是氧化铁、稀硫酸和硫酸铜,氧化铜与稀硫酸反应生成硫酸铜和水,反应的方程式为:CuO+ H2SO4 == CuSO4+H2O。
2Fe+3CO2。由分析可知,EGF分别是氧化铁、稀硫酸和硫酸铜,氧化铜与稀硫酸反应生成硫酸铜和水,反应的方程式为:CuO+ H2SO4 == CuSO4+H2O。
(3)H、甲、B分别是二氧化碳,C和一氧化碳,碳与二氧化碳在高温的条件下反应生成一氧化碳,反应的方程式为:CO2+C![]() 2CO。
2CO。

【题目】实验课上,某小组同学在老师的指导下用碳粉还原氧化铁,实验结束后,发现试管中残留黑色固体,同学们对此产生了浓厚的兴趣,于是进行下列探究:
〖提出问题〗反应后试管中剩余的黑色固体是什么?
〖查阅资料〗常见铁的氧化物部分性质如下表所示:
常见铁的氧化物 | Fe粉 | FeO | Fe2O3 | Fe3O4 |
与酸反应能否溶解 | 能 | 能 | 能 | 能 |
颜色 | 黑 | 黑 | 红 | 黑 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
〖猜想与假设〗甲同学:FeO和C 乙同学:Fe和C 丙同学:Fe和Fe2O3 丁同学:Fe和Fe3O4
__________ 同学的猜想提出后,即被小组其他的同学否定,原因是____________
〖验证实验〗小组同学按照下列方案进行实验:
实验步骤 | 实验现象 | 实验结论 |
用磁铁吸引该黑色固体 | 黑色固体被吸引 | ____同学猜想不正确 |
取适量反应后的黑色固体于试管中,并向其中加入足量的稀盐酸 | _____________ | 乙同学猜想正确 |
〖实验反思〗已知碳粉还原氧化铁还会产生CO2,写出该反应的化学方程式_______________