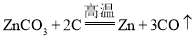题目内容
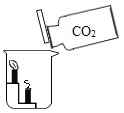
【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)
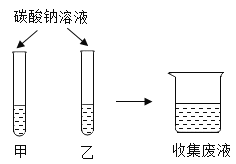
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为:_______。
(2)为处理实验废液,小组同学对废液成分进行探究:
(提出问题)假设二氧化碳全部逸出,废液中的溶质是什么?
(分析)小涛认为一定有氯化钠时,其依据是________。
(猜想)可能有HC1、Na2CO3、CaCl2中的一种或两种。
(设计实验)(本环节可供选择的试剂有稀盐酸、碳酸钠溶液、氯化钙溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | ______ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | 取烧杯中溶液样品,滴加足量的_____溶液 | _______ | 溶液中含有CaCl2 |
(结论)废液中的溶质是HCl、NaCl、CaCl2。
(反思)小梅认为根据步骤①的现象,步骤②可以省略,原因是_________;
(应用)若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰,石灰石三种物质中,应该选择_________。
【答案】Na2CO3+2HCl=2NaCl+H2O+CO2↑ 碳酸钠与氯化钙、稀盐酸反应后均生成氯化钠 产生气泡,溶液由无色变为浅绿色 碳酸钠 产生白色沉淀 碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠与盐酸不能在同一溶液中共存 石灰石
【解析】
(1)碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀,试管甲中观察到有白色沉淀生成,则试管甲中原溶液为氯化钙溶液,试管乙中的溶液为稀盐酸,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,故反应的化学方程式写为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(2){分析}碳酸钠与氯化钙、稀盐酸反应后均生成氯化钠,所以废液中一定有氯化钠,故填碳酸钠与氯化钙、稀盐酸反应后均生成氯化钠。
{设计实验}①溶液中含有HCl,取溶液样品置于烧杯中,加入铁粉,铁粉与盐酸反应生成氯化亚铁和氢气,观察到的现象是产生气泡,溶液由无色变为浅绿色,故填产生气泡,溶液由无色变为浅绿色;
③溶液中含有CaCl2,氯化钙与碳酸钠反应生成碳酸钙沉淀,所以可向溶液中加入碳酸钠溶液证明氯化钙是否存在,故填碳酸钠;
碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,观察到的现象是产生白色沉淀,故填产生白色沉淀。
{反思}碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,即碳酸钠与盐酸不能在同一溶液中共存,溶液中含有盐酸,就不可能含有碳酸钠,故填碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠与盐酸不能在同一溶液中共存。
{应用}废液中含有盐酸,氢氧化钠能与盐酸生成氯化钠和水,无明显现象,无法判断盐酸是否除尽,氢氧化钠可能过量,溶液显碱性,选项错误;
生石灰就是氧化钙,氧化钙与盐酸反应生成氯化钙和水,无明显现象,无法判断盐酸是否除尽,生石灰过量,溶液显碱性,选项错误;
石灰石与盐酸反应生成氯化钙、水和二氧化碳,产生气泡,且石灰石不溶于水,如加入过量,过滤除去即可中性溶液,选项正确,故填石灰石。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】酱油是中国的传统调味品。下表是某酱油油膏的部分营养成分列表,根据所学知识回答。
酱油膏的部分营养成分列表(每100克中含) | |||||
成分名称 | 含量 | 成分名称 | 含量 | 成分名称 | 含量 |
水分(克) | 54.7 | 蛋白质(克) | 13 | 脂肪(克) | 0.7 |
糖类(克) | 10.2 | 钠(毫克) | 7700 | 钙(毫克) | 46 |
铁(克) | 8.6 | 硒(微克) | 2.96 | …… | …… |
(1)上表中不含六大基本营养素中_____________;
(2)上表中“钠”、“钙”等指是___________(填“单质”“分子”“原子”或“元素”);
(3)老年人每天都要摄入足量的钙,有利于防止___________________;
(4)糖类主要是给人体提供能量,写出葡萄糖(C6H12O6)在酶的作用下进行呼吸作用的化学方程式______________。