题目内容
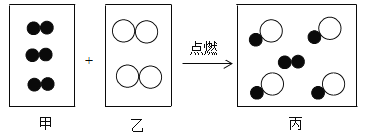
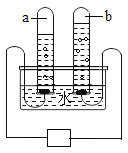
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为: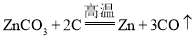
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
【答案】D
【解析】
通过题干分析可知,将一定量的碳酸锌装入泥罐内,然后将碳放入,使其充分混合,并不断用以高温煅烧,结束后,待装置冷却到室温,将泥罐打碎,即可得到金属锌,并且同时生成了一氧化碳。
A、通过分析可知,煤炭中主要起作用的是单质C。A正确;
B、通过分析可知,该反应冶炼锌的是碳酸锌和碳单质在高温下反应生成锌单质和一氧化碳。故方程式为: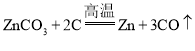 。B正确;
。B正确;
C、通过分析可知,单质碳和化合物碳酸锌反应生成单质锌和化合物一氧化碳,属于置换反应。C正确;
D、通过分析可知,得到的固体产物为金属锌,该反应中不含有铅元素,所以不可能生成铅。D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组发现,上周做实验用的氢氧化钠固体忘记了盖瓶盖,他们欲对该固体的变质情况进行探究。
(提出问题)该瓶氢氧化钠固体是否变质,变质情况如何?
(查阅资料)①碳酸钠溶液的pH最大约为10.6,饱和的碳酸氢钠溶液约为8.0,氯化钙溶液呈中性。
②NaOH、Na2CO3分别在水和酒精中的溶解度如下表所示:
物质种类 | NaOH | Na2CO3 | |||
温度 | 20℃ | 40℃ | 20℃ | 40℃ | |
溶剂 | 水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 | |
(作出猜想)猜想Ⅰ:固体未变质;
猜想Ⅱ:固体部分变质;
猜想Ⅲ:固体全部变质。
(实验探究)(1)兴趣小组同学取少量样品于烧杯中,加适量水溶解,测得溶液的pH约为12。由此他们得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是______。
(2)组内其他同学取步骤(1)烧杯中少量溶液于试管中,加入过量的____溶液,振荡,有白色沉淀生成;不再产生沉淀时,取上层清液于另一支试管中,滴加____,溶液变红。
(实验结论)通过实验,兴趣小组证明猜想__正确。
(反思评价)根据查阅资料,有同学提出可以通过氢氧化钠和碳酸钠在酒精中溶解度不同来验证猜想Ⅲ正确。请你帮助他设计实验方案:_____。
(实验拓展)实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取一定量样品,溶于水配成250.0mL溶液将pH=1的稀盐酸逐滴加入体积为25.0mL的该溶液中,所得曲线如图所示:
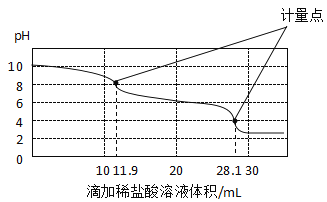
a.上一个计量点前发生反应的化学方程式为_____。
b.下一个计量点时溶液中大量存在的阴离子是_______。
【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为:_______。
(2)为处理实验废液,小组同学对废液成分进行探究:
(提出问题)假设二氧化碳全部逸出,废液中的溶质是什么?
(分析)小涛认为一定有氯化钠时,其依据是________。
(猜想)可能有HC1、Na2CO3、CaCl2中的一种或两种。
(设计实验)(本环节可供选择的试剂有稀盐酸、碳酸钠溶液、氯化钙溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | ______ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | 取烧杯中溶液样品,滴加足量的_____溶液 | _______ | 溶液中含有CaCl2 |
(结论)废液中的溶质是HCl、NaCl、CaCl2。
(反思)小梅认为根据步骤①的现象,步骤②可以省略,原因是_________;
(应用)若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰,石灰石三种物质中,应该选择_________。