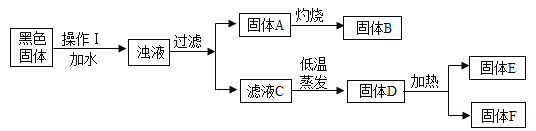
题目内容
【题目】空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。请按要求回相关问题:
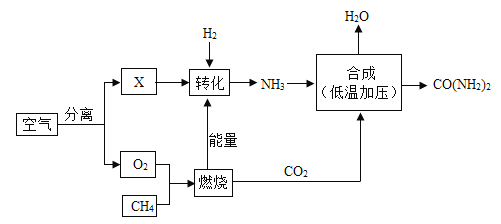
(1)图中分离空气的过程属于_____变化(填“物理”或“化学”)。
(2)X是空气中含量最多的气体,其化学式为_____;物质X与H2转化为NH3的化学反应基本类型为:_____。
(3)尿素[CO(NH2)2]中氮元素的质量分数_____。(结果保留0.1%)
(4)尿素属于氮肥,写出NH3合成尿素的化学反应方程式_____。
【答案】物理 N2 化合反应 46.7% 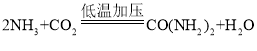
【解析】
(1)图中分离空气的过程没有生成新物质,属于物理变化;故填:物理;
(2)X是空气中含量最多的气体,所以X是氮气,化学式为N2;氮气和氢气反应生成氨气,该反应的特征是多变一,属于化合反应;故填:化合反应;
(3)尿素中氮元素的质量分数为![]() ×100%≈46.7%,故填:46.7%;
×100%≈46.7%,故填:46.7%;
(4)二氧化碳和氨气在低温加压的条件下生成尿素和水,化学方程式为: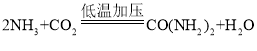 ,故填:CO2+2NH3
,故填:CO2+2NH3 CO(NH2)2+H2O。
CO(NH2)2+H2O。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】现有混合均匀的锌银粉末,某化学兴趣小组为了测定其组成,取30g样品于烧杯中,向其中分3次加入溶质质量分数相同的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 23.5 |
第2次 | 40 | 13.5 |
第3次 | 10 | m |
试回答下列问题:
(1)上述表格中m的值为_____;
(2)该金属粉末中锌的质量分数是多少_____?
(3)所用稀硫酸中硫酸的质量分数是多少_____?
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_____(填字母,下同)。
A 铁钳 B 铁锅 C 刀具
(2)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理________。
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸(主要成分是盐酸)的作用下转化为人体可吸收的铁元素,反应的化学方程式为______________。
(4)“纳米α-Fe粉”可用于食品保鲜,称为“双吸剂”,因为它能吸收空气中的____和_____。
II.铁的冶炼。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:________;
(2)高炉炼铁中,焦炭的作用_________,_____。(用化学方程式表示)
Ⅲ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
(查阅资料):
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
②NaOH溶液可以吸收二氧化碳。
③浓硫酸是一种常用的干燥剂。于是他设计了下图的实验装置,结合装置回答下列问题:
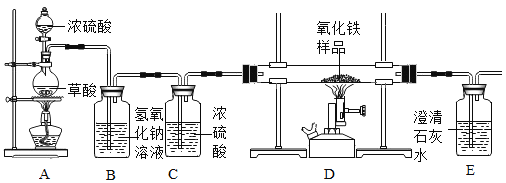
(1)图中装置C作用是_____________;
(2)装置E中澄清石灰水的作用是_______;
(3)从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热_____(填A或D)处。实验结束应_____(先或后)停止加热该处,这样做的主要目的是_______。
(4)该装置设计有一个明显缺陷,你认为是____________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当D中固体全部变黑后,停止加热,继续通入CO直到玻璃管冷却。将得到的黑色固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
(查阅资料):a.铁的氧化物在足量的稀盐酸中均能全部溶解,但无气泡产生。
b.Fe2O3与CO反应的固体生成物可能情况如下:
![]()
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②__________ ;③Fe3O4 和FeO。
(6)定量分析 用电子天平称量得部分数据如下:(玻璃管质量60.0 g)
反应前 | 反应后 | |
玻璃管及其中固体的质量 | 66.0g | 65.8 g |
根据上述数据,纯净的Fe2O3固体质量为_______g,通过上述数据,可推断出反应后黑色固体的成分_________, 根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:_____。