题目内容
【题目】高铁酸钾(K2FeO4)是一种新型、绿色、高效水处理剂。干燥的高铁酸钾在 198℃以下是稳定的,受 热则易分解为金属氧化物和氧气。高铁酸钾遇水会发生反应(4K2FeO4+10H2O═4Fe(OH)3↓+8X+3O2↑), 可将其应用到游泳池水的循环再生使用,它不仅消毒杀菌、去除人体带入的污渍和悬浮固体,且对人体 无伤害与刺激, 安全无异味。
(1)X 的化学式为_____;
(2)K2FeO4 中铁元素的化合价为_____ 价;
(3)保存 K2FeO4 应注意_____;
(4)有关 K2FeO4 的说法正确的是_____ ;
A K2FeO4 由 7 个原子构成
B K2FeO4 中钾、铁、氧元素的质量比为 2:1:4
C K2FeO4 的相对分子质量为 198
D K2FeO4 中铁元素质量分数最大
(5)生成的 Fe(OH)3 能吸附游泳池水中的悬浮杂质,每 1000 吨游泳池水中需要 Fe(OH)3 2.14 千克为 最佳,那么一个拥有 2000 吨水的游泳池需要投入 K2FeO4 的质量是多少?_____(写出解题过程)
【答案】KOH +6 在干燥、低温的条件下保存(避免潮湿和受热) C 7.92kg
【解析】
(1)由反应的化学方程式可以知道,反应前有8个钾原子,4个铁原子,20个氢原子,26个氧原子,反应后有4个铁原子,12个氢原子,18个氧原子,由质量守恒定律可知,X为KOH,分子个数为8;
(2)在K2FeO4中,由于钾显+1价、氧显-2价,所以,高铁酸钾中铁元素的化合价+6;
(3)由于干燥的高铁酸钾在198摄氏度以下是稳定的,受热易分解为金属氧化物和氧气.所以,在保存高铁酸钾时应注意干燥、低温;
(4)A、K2FeO4 由钾离子和高铁酸根离子构成,故错误;
B、高铁酸钾中钾、铁、氧元素质量比为:(39×2):56:(16×4)≠2:1:4,故错误;
C、K2FeO4的相对分子质量是39×2+56+16×4=198,故正确;
D、由B可知,K2FeO4 中钾元素质量分数最大,故错误;
故选:C。
(5)设一个拥有 2000 吨水的游泳池需要投入 K2FeO4 的质量为x:
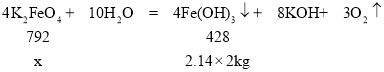
![]()
x=7.92kg
一个拥有 2000 吨水的游泳池需要投入 K2FeO4 的质量是7.92kg。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某化学兴趣小组同学发现,除二氧化锰外其他物质也能作氯酸钾分解的催化剂,那么氧化铜是否能作氯酸钾分解的催化剂?于是进行了如下的探究。
提出问题:氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
设计实验:同学们设计了下面三组实验,实验中“待测数据”是生成相同体积的氧气所需时间(其它可能影响实验的因素均忽略)。
实验编号 | 氯酸钾 | 其它物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | 二氧化锰0.5g | |
③ | xg | 氧化铜0.5g |
问题讨论:
(1)实验②中反应的文字表达式是_____,实验③中x的数值为_____。
(2)由实验③与实验_____的“待测数据”相对比,若实验③“待测数据”更_____(填“大”或“小”),则说明氧化铜能加快氯酸钾的分解速率。
反思提升:
(1)若要证明氧化铜是该反应的催化剂,还要设计实验验证它在化学反应前后的_____和_____不变。
(2)你认为同学们设计实验②和实验③的对比的目的是_____。