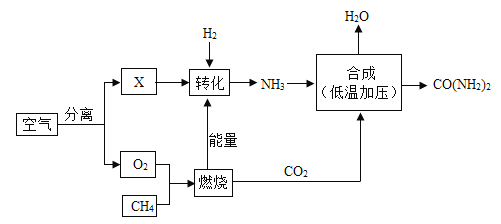
题目内容
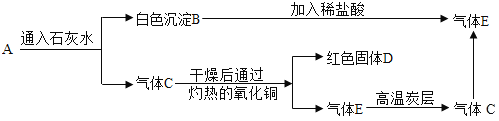
【题目】图中A为一种混合气体,其质量为8g。经分析知A只含两种元素,且有如图所示的转化关系。
(1)根据图中的转化关系写出A→B过程中发生反应的化学方程式:_____
(2)实验后,测得所得红色固体D的质量为3.2g。那么混合气体A中气体C的质量分数是多少?_____(请写出计算过程)
【答案】Ca(OH)2+CO2═CaCO3↓+H2O 17.5%
【解析】
已知A是混合气体,且含两种元素,通过石灰水生成白色沉淀B,可推断B是碳酸钙,则A中一定含有二氧化碳气体;向碳酸钙中加入稀盐酸生成气体E,E就是二氧化碳;气体C与灼热的氧化铜反应生成红色固体D是金属铜,同时生成E是二氧化碳,那么C就是一氧化碳,从而推出A是二氧化碳和一氧化碳的混合气体.
(1)A→B 是二氧化碳和澄清石灰水的反应,其方程式为Ca(OH)2+CO2═CaCO3↓+H2O.故填:Ca(OH)2+CO2═CaCO3↓+H2O;
(2)设一氧化碳的质量为x
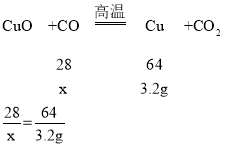
x=1.4g
混合气体A中气体C的质量分数是![]() ×100%=17.5%。
×100%=17.5%。
故填:17.5%。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目