题目内容
【题目】下列有关钠在氯气中燃烧的实验(化学方程式为:2Na+Cl2 2NaCl),分析合理的是( )
2NaCl),分析合理的是( )
A.钠能在氯气中燃烧,说明燃烧不一定需要氧气参与
B.钠在氯气中燃烧时,钠原子得到电子
C.反应物钠由分子构成,生成物氯化钠由离子构成
D.钠在氯气中燃烧生成的氯化钠与家庭食用的氯化钠化学性质不同
【答案】A
【解析】
已知钠能在氯气中燃烧,化学方程式为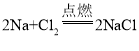 ,则有:
,则有:
A、钠能在氯气中燃烧,说明燃烧不一定需要氧气参与,A选项分析合理,符合题意;
B、钠在氯气中燃烧时,钠原子失去电子变成钠离子,B选项分析不合理,不符合题意;
C、反应物钠由原子构成,生成物氯化钠由离子构成,C选项分析不合理,不符合题意;
D、钠在氯气中燃烧生成的氯化钠与家庭食用的氯化钠化学性质相同,D选项分析不合理,不符合题意。故选A。

练习册系列答案
相关题目
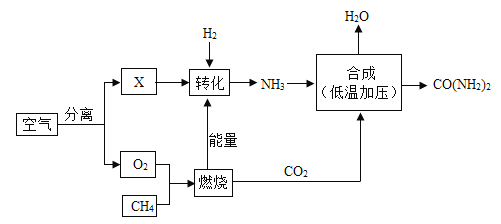
【题目】利用氢气(H2)和空气中分离出的氮气(N2)可以合成氨气(NH3),下列是合成氨的工艺流程图:
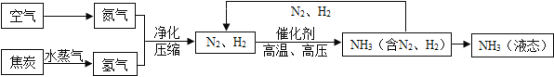
(1)根据下表中各物质的沸点,如要将产物 NH3 与 N2、H2 分离开来,温度应该控制在_____℃的范围之内。
物质 | H2 | N2 | NH3 |
沸点/℃ | -252 | -195.8 | -33.4 |
(2)用“〇”表示氢原子,“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示 催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
”表示 催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为_____(将下面三张图用序号排列)。
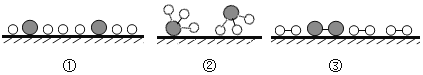
(3)用焦炭(主要成分是碳)和水蒸气在高温条件下反应可制得氢气和另一种常温下为气态的有毒物 质,该反应的化学方程式:_____。 在煤和水蒸气反应前需先将煤粉碎,这样做的目的是_____。
(4)生产中 N2、H2 不可能全部转化为 NH3。将降温分离出的 N2、H2 送回合成塔目的是_____。
A充分利用原料 B防止氮气污染空气