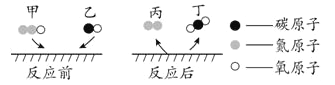
题目内容
【题目】某化学实验小组对“影响石灰石与盐酸反应速率的因素一一盐酸的浓度 和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
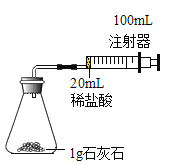
进行实验 室温下,选用20mL不同浓度的盐酸(4%和6%)分别与lg颗粒状或块状的石灰石进行实验( 固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________。
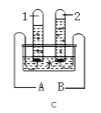
(2)按如图所示装置进行实验,在装药品前应检查该装置的气密性,具体的做法是连接好仪器,拉动注射器活塞,然后松开手,若______,说明装置气密性良好。开始实验时,应将20mL稀盐酸_____(选填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
处理数据 实验小组进行实验后,获得的相关实验数据如表所示:
实验编号 | 盐酸的溶质质量分数(均取20 mL) | 石灰石固体形状(均取1g) | 二氧化碳的体积/mL(均收集前30 s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
(3)①要比较不同浓度的盐酸对反应速率的影响,可选择的实验编号是_____(写一组), 由此可得到的结论是_________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_________。
(4)如下表是实验时记录生成的二氧化碳气体的体积和对应时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变慢,其原因是__________。
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ 活塞又回到原位 快速 ac或bd 溶质质量分数越大,反应的速率越快 颗粒越小,反应的速率越快 反应物的浓度减小
【解析】
(1)石灰石与盐酸反应生成氯化钙、水和二氧化碳,其反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑。
(2)在装药品前应检查该装置的气密性,具体的做法是将将注射器活塞向外拉出一段,松开手一会后,若活塞又回到原位,证明装置气密性良好;开始实验时,因为盐酸和碳酸钙反应生成的二氧化碳会使装置内的压强增大,故应将20ml的稀盐酸快速的推入锥形瓶中,以保证盐酸能全部推入锥形瓶中,故填:活塞又回到原位;快速。
(3)①要比较不同浓度的盐酸对反应速率的影响,需要盐酸的溶质质量分数不同,石灰石固体的颗粒相同,故可选择的实验编号是ac或bd;根据相同的时间收集的二氧化碳的体积可以看出,溶质质量分数越大,反应的速率越大,故填:ac或bd;溶质质量分数越大,反应的速率越快。
②当颗粒大小相同时,相同的时间收集的二氧化碳的气体的体积可以看出,颗粒越小,反应的速率越快,故填:颗粒越小,反应的速率越快。
(4)从表格数据可以分析得出,开始反应的速率大,后来的反应速率小,主要是因为随着反应的进行,反应物被消耗,浓度减小。故填:反应物的浓度减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案