题目内容
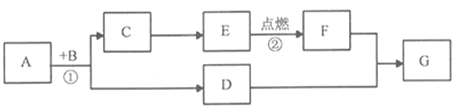
【题目】归纳和总结是学习化学的重要方法。小李在复习单质、氧化物、酸、碱和盐化学性质时,构建了下方知识网络图,有许多不同类别的物质在发生化学反应时,都可能有盐生成,如图所示:

(1)写出一个酸和碱反应生成硫酸铜的化学方程式:_______________。
(2)请你把图中①②处补充完整,要求不能与图中已有的信息重复。①____________;②_______________。
(3)借助网络图可进行物质的检验。如现对某一工业含盐废水溶液按下列步骤进行实验(假设能发生的反应均恰好完成反应)。根据以下事实回答问题:

a.操作I、II均为___________,需要用到的玻璃仪器有烧杯、玻璃棒和________。
b.若废水溶液中仅含有一种溶质时,该溶质是_________(填化学式);其与AgNO3反应的化学方程式为___________________________。
c.当废水溶液中含有两种溶质时,除“b”中所写溶质外,还可能存在的盐是_____(写出两种即可)。
【答案】Cu(OH)2+H2SO4=CuSO4+2H2O 金属+盐 酸+盐 过滤 漏斗 FeCl3 FeCl3+3AgNO3=Fe(NO3)3+3AgCl↓ 硝酸钠、硝酸铁或氯化钠
【解析】
(1)氢氧化铜是一种碱,硫酸是一种酸,硫酸与氢氧化铜发生中和反应生成硫酸铜和水;反应的化学方程为:Cu(OH)2+H2SO4=CuSO4+2H2O;
(2)根据盐的性质可知,金属与盐溶液发生置换反应会生成新的金属与新的盐;酸与盐发生复分解反应生成新的酸与新的盐;
(3)a.操作I、Ⅱ是将难溶性固体与液体分离的方法,即过滤操作,需要用到的玻璃仪器有烧杯、玻璃棒和漏斗;
b.往废水中加入硝酸银溶液后有白色沉淀氯化银生成,说明原废水中一定含有Cl-,而在有色溶液中加入氢氧化钠溶液有红褐色沉淀Fe(OH)3和硝酸钠生成,说明有色溶液中一定含有硝酸铁,因此废水溶液中一定还有Fe3+,若废水溶液中仅含有一种溶质时,该溶质是氯化铁,氯化铁与硝酸银反应生成氯化银白色沉淀和硝酸铁;反应的化学方程为:FeCl3+3AgNO3=Fe(NO3)3+3AgCl↓;
c.当废水中含有多种溶质时,还有可能含有硝酸钠、硝酸铁或氯化钠。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】某化学实验小组对“影响石灰石与盐酸反应速率的因素一一盐酸的浓度 和石灰石的颗粒大小等”进行了如下实验探究,请你参与。

进行实验 室温下,选用20mL不同浓度的盐酸(4%和6%)分别与lg颗粒状或块状的石灰石进行实验( 固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________。
(2)按如图所示装置进行实验,在装药品前应检查该装置的气密性,具体的做法是连接好仪器,拉动注射器活塞,然后松开手,若______,说明装置气密性良好。开始实验时,应将20mL稀盐酸_____(选填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
处理数据 实验小组进行实验后,获得的相关实验数据如表所示:
实验编号 | 盐酸的溶质质量分数(均取20 mL) | 石灰石固体形状(均取1g) | 二氧化碳的体积/mL(均收集前30 s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
(3)①要比较不同浓度的盐酸对反应速率的影响,可选择的实验编号是_____(写一组), 由此可得到的结论是_________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_________。
(4)如下表是实验时记录生成的二氧化碳气体的体积和对应时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变慢,其原因是__________。