题目内容
【题目】(一)下图是实验室制取气体的部分装置,请根据实验装置(部分固定装置已省略)回答问题:
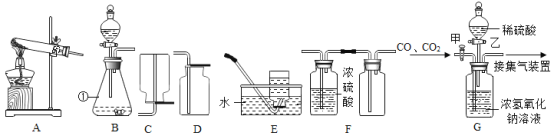
(1)图中标识①仪器的名称是:__________;
(2)实验室既可以制取CO2,又可以制取O2的发生和收集装置组合为:_______;(在A—E中选)
(3)若用F装置收集一瓶干燥的某气体,则该气体可能是_____;(填字母代号)
A.O2 B.NH3 C.H2 D.CO2
(4)如 B 装置分液漏斗改为长颈漏斗并增加多孔塑料板来制取二氧化碳,其优点为:_______。
(5)工业上常需分离CO、CO2的混合气体。某同学采用装置G也能达到分离该混合气体的目的,操作步骤如下:
①关闭活塞乙,打开活塞甲,通入混合气体,可收集到_____气体;
②然后,______填操作),又可收集到另一种气体。
(二)小红和她的同学学习了稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
(提出问题)猜想Ⅰ:铜与浓硫酸不能反应;
猜想Ⅱ:铜与浓硫酸能反应,且可能生成氢气。
(实验探究)实验Ⅰ:在一支试管中加入一小片铜,再加入少量的浓硫酸,放置一段时间,试管中无现象;
实验Ⅱ:再给上述试管加热,试管中产生有刺激性气味的气体,将反应后的溶液小心地注入到盛有少量水的烧杯中,溶液呈现出明显的蓝色。
(分析猜想)①溶液呈蓝色,说明生成了 _______________(填化学式)。
②根据实验现象及已有的知识推断,产生的气体不可能是氢气,很可能是一种含硫元素的气体。
(查阅资料)①常见的含硫元素的气体有二氧化硫和硫化氢。
②二氧化硫和二氧化碳相似,都能和氢氧化钠等碱溶液反应生成盐和水。
③二氧化硫能使品红溶液褪色,加热,又能恢复原来的红色。硫化氢不能使品红溶液褪色。
④二氧化硫和硫化氢均有毒。
(实验探究)为了检验产生的有刺激性气味的气体的成分,小红和她的同学进一步实验: 将产生的气体通入品红溶液中,品红溶液褪色,加热,溶液又恢复了红色。
(实验结论)①在常温下,铜与浓硫酸不能反应
②在加热条件下铜与浓硫酸反应产生的气体是_____(填化学式),此反应还生成了水,请写出该反应的化学方程式_____;
③浓硫酸与铜加热时能反应,而稀硫酸与铜即使加热也不能反应,由此说明:物质的化学性质除了与物质本身的性质有关外,还可能与溶液中溶质的_____有关。
(拓展延伸)为了防止污染空气,小红和她的同学采用氢氧化钠溶液来吸收多余的气体, 请写出该反应的化学方程式_____。
【答案】锥形瓶 BD AD 可以控制反应的发生与停止 CO 关闭甲,打开乙 CuSO4 SO2 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 浓度大小或质量分数大小 SO2+2NaOH═Na2SO3+H2O
CuSO4+SO2↑+2H2O 浓度大小或质量分数大小 SO2+2NaOH═Na2SO3+H2O
【解析】
(一)(1)仪器①是锥形瓶,故填:锥形瓶;
(2)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。故填:BD;
(3)若用F装置收集一瓶干燥的某气体,则该气体可能是氧气、二氧化碳,因为氧气和二氧化碳密度大于空气,集气瓶中进气管长,且这两种气体不与浓硫酸反应;故答案为:AD;
(4)如 B 装置分液漏斗改为长颈漏斗并增加多孔塑料板来制取二氧化碳,其优点为:可以控制反应的发生与停止。故填:可以控制反应的发生与停止;
(5)二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,所以
①关闭活塞乙,打开活塞甲,通入混合气体,可收集到气体是CO;
②然后,关闭活塞甲,打开活塞乙,又可收集到二氧化碳;
故填:CO;关闭甲,打开乙;
(二)[分析猜想]①溶液变蓝,说明有硫酸铜生成,故填:CuSO4;
[实验结论]:②品红溶液褪色说明有二氧化硫生成,铜能与浓硫酸在加热时反应生成硫酸铜、二氧化硫和水,故填:SO2;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
③铜不能与稀硫酸反应,可以与浓硫酸反应,说明化学反应与反应物的浓度有关,故填:浓度大小或质量分数大小;
[拓展延伸]二氧化硫能与氢氧化钠反应生成亚硫酸钠和水,故填:SO2+2NaOH═Na2SO3+H2O。

【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A. 实验①所得溶液质量分数为10%
B. 实验说明25℃时该物质的溶解度是20g
C. 实验③④所得溶液质量分数相同
D. 实验④所得溶液中含溶质20g
【题目】根据金属的化学性质并结合表中信息,填写下表空白。
反应物 | 反应规律 | 反应规律的应用举例 |
金属+O2 | 大多数金属能和O2反应生成金属氧化物 | 铝表面形成一层致密薄膜阻止铝进一步氧化,该薄膜的化学式为________ |
金属+酸 | 在金属活动性顺序里,位于氢前面的金属能与盐酸、稀硫酸发生置换反应,生成盐和H2 | 写出用稀硫酸鉴别黄金和黄铜(铜锌合金) 的化学方程式______ |
金属+盐 | 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来,生成_____ | 用Cu、Mg、Zn中的两种金属分别放 入_____溶液中,即可比较出上述三种金属的活动性强弱 |