题目内容
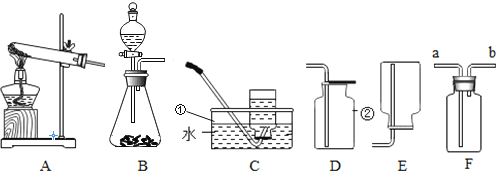
【题目】在实验室里,甲同学用氯酸钾和二氧化锰混合固体加热制取一定量的氧气后,得到44.4 g的固体。乙同学继续加热这些固体至完全反应后又制得了一些氧气,同时得到的34.8g固体,乙同学将其充分溶解于170.2 g水中,搅拌后过滤,得一定质量的滤液,并将过滤后所得固体洗涤、干燥,得到5g黑色固体。请回答下列问题:
(1)甲同学的实验中发生反应的化学方程式为_____;
(2)乙同学所做的实验中制得氧气的质量为_____;
(3)在乙同学的实验中,列出求解氯酸钾质量(x)的比例式_____;
(4)上述实验所得滤液中溶质的质量分数为_____;
(5)甲同学和乙同学在实验中消耗氯酸钾的质量比为_____;
(6)上述氯酸钾和二氧化锰混合固体中氯酸钾的含量为_____。
【答案】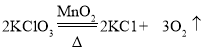 9.6g 245/96=x/9.6g 14.9% 1:1 90.7%
9.6g 245/96=x/9.6g 14.9% 1:1 90.7%
【解析】
本题是有关氯酸钾和二氧化锰制取氧气的相关计算。利用题目分析5g黑色固体为二氧化锰,根据二氧化锰的质量求出生成氯化钾的质量,再用化学方程式和氯化钾的质量进行相关计算。
(1)氯酸钾和二氧化锰制氧气的化学方程式为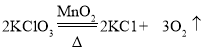 。
。
(2)乙同学把44.4 g的固体继续加热至完全反应后又制得了一些氧气,同时得到的34.8g固体,制得氧气的质量为![]() 。
。
(3)解:设44.4 g的固体中含氯酸钾质量为X。
![]()
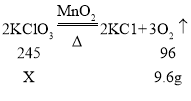
所以求解氯酸钾质量(x)的比例式为:![]()
(4)完全反应后得到的34.8g固体,该固体中由二氧化锰和氯化钾组成,二氧化锰的质量为5g,氯化钾的质量为:![]() ,
,
实验所得滤液中溶质的质量分数为:![]() 。
。
(5)解:设原混合物中氯酸钾的质量为Y。
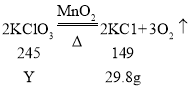
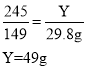
乙同学在实验中消耗氯酸钾的质量为![]() 解得X=24.5g。
解得X=24.5g。
那么甲同学和乙同学在实验中消耗氯酸钾的质量比为![]()
(6)氯酸钾和二氧化锰混合固体中氯酸钾的含量为![]() 。
。

【题目】某有机物R完全燃烧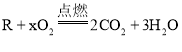 ,实验测得反应前后各物质的质量如下表:
,实验测得反应前后各物质的质量如下表:
物质 | R | 氧气 | 二氧化碳 | 水 |
反应前质量(g) | 4.6 | 9.6 | 0 | 0 |
反应后质量(g) | 0 | 0 | 8.8 | 5.4 |
请计算:
(1)8.8g二氧化碳中碳元素的质量是_____g。
(2)5.4g水中氢元素质量是0.6g,依据_____,则R中氢元素质量也是0.6g;所以R中氧元素质量是_____g。
(3)设R的化学式为CaHbO,则a:b=_____。