题目内容
【题目】碳酸氢钠受热易分解,充分加热24.8g含碳酸钠的碳酸氢钠固体,完全反应后剩余固体的质量为18. 6g,则生成二氧化碳的质量为_____ g;将50g镁、锌的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g固体(已换算成无水硫酸盐)。则反应产生氢气的质量是_____g。
【答案】4.4 3.5
【解析】
设:生成二氧化碳的质量为x。
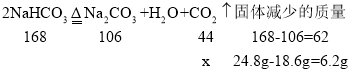
![]() ,x=4.4g;则生成二氧化碳的质量为4.4g。
,x=4.4g;则生成二氧化碳的质量为4.4g。
设生成氢气的质量为y。
镁、锌与足量的稀硫酸反应的化学方程式为:Zn + H2SO4 = ZnSO4 + H2↑,Mg + H2SO4 = MgSO4 + H2↑。反应的生成物可设为ASO4,生成的硫酸盐中的硫酸根离子质量=218g-50g=168g;则有:
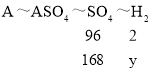
![]() ,y=3.5g;则反应产生氢气的质量是3.5g。
,y=3.5g;则反应产生氢气的质量是3.5g。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目