题目内容
【题目】化学兴趣小组进行铁生锈的实验探究活动:
[探究一]铁生锈的条件
[实验 1]将洁净无锈的铁丝置于如图一所示装置中,关闭止水夹 K, 经过一段时间观察,装置中的铁丝没有锈迹。
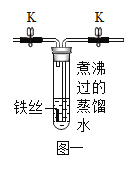
(1)蒸馏水经过煮沸的目的是_______________。
(2)铁丝没有锈迹说明了______________。
[实验 2]打开止水夹 K,通入 O2,排出试管中的水(试管底部留少量的水),如图二所示,关闭止水夹 K,经过一段时间观察到铁丝生锈严重。
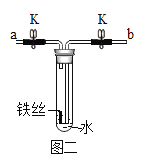
(3)通入 O2 时,应从__________端(填“a”或“b”)通入。
[实验 3]兴趣小组认为根据以上两个实验的现象还不足以得出铁生锈是与氧气和水共同作用的结论,于是利用图一装置补做了一个实验。
(4)简述兴趣小组补做实验的具体方法方法和观察到的现象______________。
[探究二] 酸性条件下铁发生腐蚀的影响因素
[实验 4]将混合均匀的铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图三)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
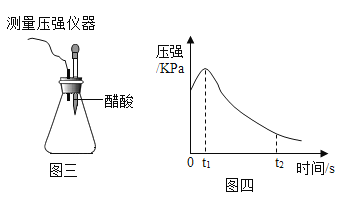
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验做参照 | 1.0 | 3.0 | 80.0 |
② | 探究醋酸浓度的影响 | 1.0 | 32.0 | |
③ | 0.5 | 3.0 | 80.0 |
资料:碳粉不参与锥形瓶中的化学反应,醋酸溶液显酸性。
(5)上表中编号②实验中铁粉的质量为_____________;编号③试验的实验目的是___________。
(6)编号①试验测得容器中压强随时间变化如图四,t2 时容器中压强明显小于起始压强,其原因是___________。
(7)兴趣小组总结了图四中 0~t1 时压强增大的原因,可能是__________。
(拓展延伸)
(8)铁锈的主要成分是 Fe2O3,它是由铁生锈过程中产生的红褐色固体 Fe(OH)3 分解产生的,写出 Fe(OH)3 受热分解产生两种氧化物的化学方程式_____________。
(9)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护层的方法。这些方法都能防止锈蚀的原理是______________。
【答案】除去水中溶解的氧气 铁锈蚀需要氧气 b 将光亮的铁丝放入盛有干燥空气的试管中,密封,过一段时间,观察到铁丝没有明显现象 3.0 探究碳粉质量的影响 铁与氧气反应 铁和醋酸反应生成氢气 ![]() 隔绝氧气和水
隔绝氧气和水
【解析】
(1)蒸馏水加入试管前应先加热煮沸,目的是:除去水中溶解的氧气;
(2)铁丝与水接触,与氧气不接触,没有锈迹说明铁锈蚀需要氧气;
(3)为了让氧气与铁丝充分接触,氧气因从长端通入,故填:b;
(4)分析两个实验得到的结论是铁锈是需要氧气,还需要验证是否跟水有关,实验方案如下:将光亮的铁丝放入盛有干燥空气的试管中,密封,过一段时间,观察到铁丝没有明显现象;
(5)对比表中数据,可知编号②实验中铁粉的质量为3.0g;编号③试验的实验目的是探究碳粉质量的影响;
(6)反应一段时间后,压强减小是应为铁与氧气反应,消耗了氧气,导致压强减小;
(7)铁和醋酸反应生成氢气,导致瓶内压强增大;
(8)Fe(OH)3 受热分解产生氧化铁,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Fe、H、O,故生成物中含铁、氧,故另一氧化物为水,反应的化学方程式为:】![]() ;
;
(9)为了防止钢铁的锈蚀,人们常采用在其表面刷油漆或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】蔗糖是生活中常见的一种物质,某兴趣小组对“蔗糖的组成”进行了探究。
【作出猜想】小组同学认为绿色植物通过光合作用将二氧化碳和水转化成葡萄糖和氧气,葡萄糖进一步转化为蔗糖,故蔗糖中一定含有碳、氢元素,可能含有氧元素。
【实验验证】
方案一:小明将蔗糖在氧气中燃烧,检验到生成产物中有水和二氧化碳,得出结论“蔗糖是由碳、氢、氧三种元素组成的”。
小刚认为该方案不合理,只能说明蔗糖中一定含有碳、氢元素,不能确定是否含有氧元素,理由是_______________________。
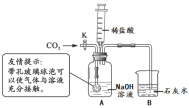
方案二:小刚用下图所示装置进行实验。实验开始先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
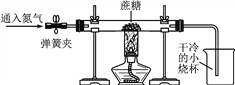
(1)观察到________________________出现,说明蔗糖中含有氢元素和氧元素。
(2)观察到硬质玻璃管中残留有黑色固体,他猜想该黑色固体是单质碳,并继续利用图示装置,另选试剂进行了验证单质碳的实验,实验过程和现象如下:
实验过程 | 实验现象 |
________________,点燃酒精灯 | ①硬质玻璃管中的黑色固体剧烈燃烧,发出白光; ②_____________ |
写出上述实验过程中一个反应的化学方程式:________________________。
【实验结论】蔗糖是由碳、氢、氧三种元素组成的。
【拓展交流】
(1)方案二中,先通入一会儿氮气的原因是___________________________________。
(2)查阅资料得知蔗糖的化学式为C12H22O11。小红发现:蔗糖分子中氢原子的数目是氧原子数目的2倍,但是,蔗糖中氧元素质量却是氢元素质量的8倍,导致出现这种情况的原因是________________________。
【题目】小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究.
【提出问题】这瓶氢氧化钠固体是否变质?
【查阅资料】CaCl2溶液呈中性.
【猜想与假设】①氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠 .
【设计实验】取氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验步骤 | 实验现象 | 结论及解释 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想 不成立 |
(2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生 | 反应的化学方程式为: |
(3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想 成立 |
【反思与交流】久置的氢氧化钠变质的原因是(用化学方程式表示) ,因此,氢氧化钠应 保存.
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100g,反应后称得烧杯中溶液的质量为114.2g.试计算:
(1)该样品中碳酸钠的质量为 ;
(2)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为 .
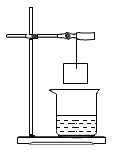
【题目】小华将一张滤纸在某指示剂 X 中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液 Y 的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂 X 和烧杯中的溶液 Y 分别是( )
A | B | C | D | |
指示剂 X | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
溶液 Y | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
A.AB.BC.CD.D